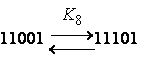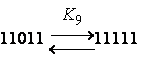МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Иркутский государственный университет
На
правах рукописи
АННЕНКОВ ВАДИМ ВЛАДИМИРОВИЧ
РЕАКЦИИ КОМПЛЕКСООБРАЗОВАНИЯ С УЧАСТИЕМ ПОЛИВИНИЛАЗОЛОВ
02.00.06 ‑ Высокомолекулярные соединения по химическим наукам
АВТОРЕФЕРАТ
диссертации на соискание ученой
степени
доктора химических наук
Работа
выполнена на кафедре высокомолекулярных соединений и органического синтеза
химического факультета ИГУ.
Научный
консультант: доктор
химических наук, профессор В.В. Сараев
|
Официальные оппоненты: |
доктор химических
наук, профессор А.Д.Помогайло доктор химических наук
С.А.Медведева доктор
химических наук, профессор А.И.Скушникова |
|
Ведущая организация: |
Химический факультет Московского Государственного
Университета им. М.В.Ломоносова |
Защита
диссертации состоится " 14 "
ноября 2001 г. в 10 часов на заседании
диссертационного совета Д212.074.06 при Иркутском государственном университете
по адресу: 664033, г. Иркутск, 33, ул. Лермонтова, 126, химический факультет,
ИГУ.
С диссертацией можно
ознакомиться в научной библиотеке Иркутского государственного университета
Отзывы
и замечания по работе просим направлять по адресу: 664003, Иркутск-3, К.Маркса
1, ИГУ, ученому секретарю О.А.Эдельштейн.
Автореферат
разослан "__"
2001 г.
Ученый
секретарь диссертационного совета,
![]() кандидат
химических наук О.А.Эдельштейн
кандидат
химических наук О.А.Эдельштейн
Общая характеристика работы
Актуальность темы. Процессы
комплексообразования с участием высокомолекулярных соединений постоянно
привлекают внимание специалистов в области полимерной и физической химии, биологии,
медицины. В последние годы стал доступен для исследований и практического
использования новый класс полимеров - поливинилазолы. Характерной чертой
соединений азольного ряда является сочетание различных физико-химических свойств в пределах простого по строению пятичленного
гетероцикла. Наличие "пиридиновых" атомов азота позволяет выступать
им в качестве р-доноров и слабых
оснований, а p-система, включающая электроноакцепторные атомы
азота, может являться p-акцептором, в то время как
циклы, содержащие незамещенные атомы водорода при азоте, проявляют свойства N-H
кислот. Основность "пиридиновых" атомов азота в азольных циклах
является промежуточной между основностью обычных аминов и слабых оснований типа
амидов, причем, изменяя количество атомов азота в цикле, можно широко варьировать
кислотно-основные свойства.
Гидрофильность азольных
структур приводит к растворимости большинства поливинилазолов в воде, что
открывает новые возможности их использования, особенно в медико-биологических
областях. К сожалению, поведение этих полимеров в водной среде, их
кислотно-основные и комплексообразующие свойства систематически не изучены.
Данные исследования несомненно важны для разработки новых
путей применения этих полимеров, понимания особенностей их физиологической активности.
Использование азолсодержащих полимеров в реакциях комплексообразования с ионами
металлов и водорастворимыми полимерами представляет значительный научный
интерес, учитывая уникальные кислотно-основные свойства азолов.
Целью настоящей работы явилось систематическое
исследование реакций комплексообразования с участием полимеров винилазолов,
выявление связи структуры и устойчивости комплексов в растворе со строением
макромолекул поливинилазолов, разработка новых подходов к конструированию
практически ценных полимерных систем.
Для достижения указанной цели в данной работе
поставлены следующие основные задачи:
-
изучение
кислотно-основных свойств гомо- и сополимеров
винилазолов;
-
создание
модели кислотно-основного равновесия в растворах полимерных электролитов на
базе теории "эффекта соседа";
-
выявление
структуры комплексов азолсодержащих полимеров с ионами переходных металлов в растворе
и конденсированном состоянии;
-
установление
закономерностей формирования и поведения в водных растворах интерполимерных
комплексов азольных поликислот и полиоснований;
-
разработка
новых биополимерных и каталитических систем на основе водорастворимых поливинилазолов.
В качестве основных
объектов исследований использовали поли-1-винилимидазол, поли-1-винил-1,2,4-триазол,
поли-5-винилтетразол, поли-5-изопропенилтетразол, а также ряд азолсодержащих
сополимеров.
Определенное внимание в
работе уделено кислотно-основным и комплексообразующим свойствам полимерных
карбоновых кислот, так как они, с одной стороны, близки по кислотности к
поли-5-винилтетразолам, а с другой – способны к образованию интерполимерных
комплексов с поли-1-винилазолами.
Работа
выполнена в соответствии с планом научно-исследовательских работ Института
нефте- и углехимического синтеза при ИГУ по темам: № 41-198-30 "Разработка
методов направленного синтеза элементосодержащих гетероциклических мономеров и
полимеров с целью получения энергоемких биологически активных структур
избирательного действия и реагентов для экологии" и № 41.198.31 "Синтез, формирование, природа
активности каталитических систем и механизм их действия в превращениях ненасыщенных
соединений", а также Института эпидемиологии и микробиологии НЦМЭ ВСНЦ СО РАМН по теме:
"Некоторые иммунологические аспекты бактерионосительства при дифтерии и
дисбактериозах, вызванных условно-патогенной микрофлорой" и при финансовой поддержке Министерства
образования РФ (грант № 97-0-9.3-29) и РФФИ (грант № 99-03-32102).
Научная новизна работы состоит в том, что в результате
систематических исследований кислотно-основных и координационных свойств азол- и карбоксилсодержащих полимеров в водной среде получены
новые данные о структуре и свойствах этих полимеров и об общих закономерностях
взаимодействий полимерных электролитов с ионами переходных металлов и водорастворимыми
полимерами:
В
работе впервые исследованы оснóвные свойства
поли-1-винил-1,2,4-триазола, а также поведение поли-1-винилимидазола и
поли-1-винил-1,2,4-триазола в щелочных средах. Показано, что поли-1-винилазолы
с двумя и тремя атомами азота в гетероцикле проявляют основные свойства из-за
наличия неподеленной электронной пары на "пиридиновом" атоме азота, а
кислотные – за счет акцепторной p-системы. Изучены
конформационные превращения в макромолекулах тетразолсодержащих N-H поликислот.
Впервые
осуществлено моделирование кислотно-основных равновесий в растворах полимерных
кислот и оснований на основе теории "эффекта соседа" для количественного описания состояния интерполимерных
комплексов в растворе.
Показано,
что комплексы тетразольных и карбоксильных полимеров с ионами Cu2+
характеризуются высокой локальной концентрацией ионов меди с ярко выраженным диполь-дипольным и обменным взаимодействием между ними; при
низких степенях нейтрализации обменные взаимодействия принимают антиферромагнитный
характер; повышение степени нейтрализации приводит, как правило, к разрушению ассоциатов
и димеров меди. На примере сополимера 1-винилимидазола и акриловой кислоты
изучена конкуренция азольных и карбоксильных групп за связывание с ионами меди
в зависимости от кислотности среды.
Исследованы
превращения полимерных карбоновых и N-H кислот, а также их комплексов с переходными
металлами под действием рентгеновского излучения.
Впервые
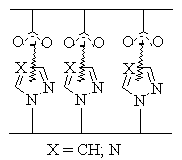
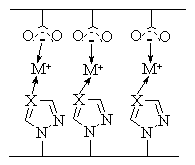
изучено образование интерполимерных комплексов на основе N‑H кислотных
поливинилтетразолов и слабых полимерных оснований, обнаружены существенные
отличия комплексообразующих свойств этих полимеров от близких по кислотности
полиакриловых кислот.
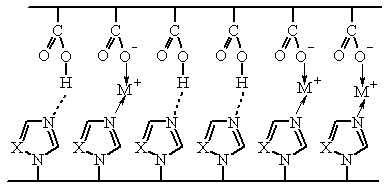
Детальное
исследование реакций поли-N-винилазолов с полимерными кислотами позволило установить
новые механизмы стабилизации этих комплексов – путем образования
донорно-акцепторных комплексов с участием p-системы азольных циклов и
взаимодействие через промежуточный катион щелочного металла.
Проведены
целенаправленные исследования взаимодействия поли-N-винилазолов
с биополимерами.
Практическая
значимость:
На
основе поливинилтетразолов созданы новые адъюванты для получения высокоиммунных
композиций с различными антигенами.
Показана
возможность разделения сложных белковых смесей с использованием
обратимо-осаждаемых полимерных систем.
Создана
принципиально новая методика конструирования эритроцитарных антигенных диагностикумов
с использованием азол- и карбоксилсодержащих полимеров
в качестве связующих агентов.
Разработан
способ синтеза нового каталитически активного металлополимера, представляющего
собой смешанный комплекс полимерной кислоты, иона переходного металла и
ацетилацетона. Выявлены
принципиальные детали механизма начальной стадии реакции окисления фенолов на медно-кобальтовых металлополимерах.
Апробация
работы. По теме диссертационной работы опубликовано 57 печатных работ, из них 1
обзор, 29 научных статей, 21 тезисов докладов, 1 методическое письмо, получено
5 авторских свидетельств и патентов. Основные результаты докладывались
и обсуждались на 2 Всероссийском Каргинском
симпозиуме "Химия и физика полимеров в начале ХХI века" (Москва,
2000), I Международном симпозиуме "Физико-химические основы
функционирования белков и их комплексов" (Воронеж, 1998), III
Всероссийской конференции по анализу окружающей среды
"Экоаналитика-98" (Краснодар, 1998), VII Международной конференции "The
problems of Solvation and Complex Formation in Solution" (Иваново, 1998) и
др. Результаты работы внедрены в практику
лечебно-профилактических учреждений Иркутской области.
Структура
работы Диссертационная работа
состоит из введения, 5 глав, выводов, библиографии и приложения. Изложена на 319 страницах машинописного текста, включая 47
таблиц, 131 рисунок и 407 литературных ссылок. Литературный обзор посвящен исследованиям
в области комплексов водорастворимых полимеров. Рассмотрены комплексы с
переходными металлами, в основном с медью (II), и интерполимерные комплексы,
среди которых основное внимание уделено системам, стабилизированным водородными
связями, как наиболее близким к теме работы. Во второй главе представлены результаты
исследования кислотно-основных свойств поли-С-винилтетразолов и
поли-N-винилазолов, а также моделирования ионизационного
равновесия в растворах полимерных кислот и оснований в рамках теории
"эффекта соседа". Третья глава посвящена изучению взаимодействия азол- и карбоксилсодержащих полимеров с ионами Cu2+.
В четвертой главе обсуждаются полимерные комплексы с участием объектов
исследования, выступающих как в качестве полимерных кислот, так и полимерных
оснований. В пятой главе приведены результаты исследования возможности
применения изучаемых полимерных систем в медико-биологических областях.
СПИСОК
ОСНОВНЫХ СОКРАЩЕНИЙ
|
ИПК |
Интерполимерный комплекс |
|
|
Н-ИПК |
Интерполимерный комплекс,
стабилизированный водородными связями |
|
|
ПК |
Полимерная кислота |
|
|
ПАК |
Полиакриловая кислота |
|
|
ПМАК |
Полиметакриловая кислота |
|
|
ПВТ |
Поли-5-винилтетразол |
|
|
ПИПТ |
Поли-5-изопропенилтетразол |
|
|
ПВАз |
Поли-1-винилазолы |
|
|
ПВИ |
Поли-1-винилимидазол |
|
|
ПВТр |
Поли-1-винил-1,2,4-триазол |
|
|
ПВПд |
Поли-1-винилпирролидон |
|
|
ПЭГ |
Полиэтиленгликоль |
|
|
ПААм |
Полиакриламид |
|
|
АК-ВИ |
Cополимер акриловой
кислоты и 1-винилимидазола |
|
|
ВТГИ-МК |
Cополимер
1-винил-4,5,6,7-тетрагидроиндола и малеиновой кислоты |
|
|
ВА-АК |
Сополимер винилацетата с
акриловой кислотой |
|
|
ВА-МАК |
Сополимер винилацетата с
метакриловой кислотой |
|
|
ВА-ВИ |
Сополимер винилацетата с
N-винилимидазолом |
|
|
БСА |
Бычий сывороточный
альбумин |
|
|
СКЧ |
Сыворотка крови человека |
|
|
ДБМФ |
2,6-Ди-трет-бутил-4-метилфенол |
|
|
ТБФ |
2,4,6-Три-трет-бутилфенол |
|
|
j |
Концентрационное
соотношение звеньев полимеров |
|
|
a |
Степень ионизации |
|
|
b |
Степень нейтрализации (СNaOH/CПК) |
|
|
g-фактор |
Фактор
спектроскопического расщепления |
|
|
A║ |
Константа сверхтонкой
структуры (СТС) в параллельной ориентации |
|
|
A┴ |
Константа сверхтонкой
структуры (СТС) в перпендикулярной ориентации |
|
|
СТВ |
Сверхтонкое
взаимодействие |
|
Основное
содержание работы
1. Кислотно-основные
свойства поливинилазолов
Все азолсодержащие
полимеры являются слабыми основаниями за счет пиридиновых атомов азота
гетероцикла. В то же время, ПВТ и ПИПТ, имеющие N-H протон,
являются кислотами, сопоставимыми по силе с карбоновыми. Процессы образования
комплексов в водной среде, особенно интерполимерных, тесно связаны с кислотно-основными
свойствами реагентов. Потенциометрический метод является мощным средством
исследования ИПК, но для его корректного применения, особенно в условиях частичной
нейтрализации полимеров, необходима модель, описывающая кислотно-основные
равновесия в полимерных растворах. В этом разделе приведены данные по
кислотно-основным свойствам азолсодержащих полимеров и сополимеров и
рассмотрены результаты моделирования ионизации полиэлектролитов.
1.1. Кислотные
свойства поли-С-винилтетразолов
Большое количество
электроотрицательных атомов азота в тетразольных циклах приводит к значительной
N-H кислотности ПВТ и ПИПТ, сопоставимой с кислотностью ПАК и ПМАК. В то же
время, для тетразолсодержащих полимеров более характерно образование регулярных
внутри- и межмолекулярных связей. В.А.Кругловой и
В.Н.Кижняевым показано [Высокомол.
соед.
Сер. Б. 1989. Т. 31. С. 420], что ПВТ в конденсированном
состоянии содержит двутяжные участки, стабилизированные водородными и ионными
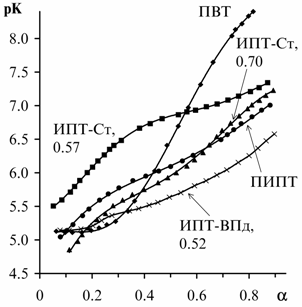
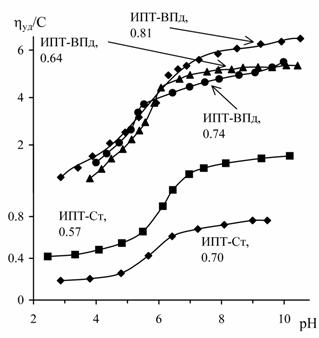
связями между тетразольными гетероциклами. Нами при исследовании
водных растворов ПВТ, ПИПТ и сополимеров ИПТ со стиролом и ВПд
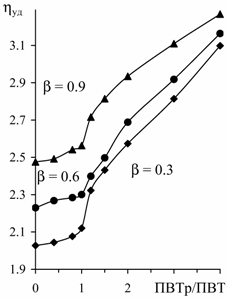
потенциометрическими и вискозиметрическими методами (рис. 1) обнаружено существование
данных макромолекул в компактной конформации при низких степенях ионизации. На
примере сополимеров ИПТ-стирол установлена преобладающая роль водородных связей
в стабилизации этих компактных структур при низком содержании гидрофобных
звеньев стирола (табл. 1).
Таблица 1
Термодинамические
характеристики конформационного перехода в сополимерах ИПТ-стирол
|
ИПТ
в сополимерах, мол.д. |
DG°
(Дж/моль) при Т,
К |
DH°, кДж/моль |
DS°, Дж/моль·К |
|||
|
278 |
293 |
313 |
333 |
|||
|
1 |
628 |
436 |
336 |
178 |
3.22 |
9.23 |
|
0.707 |
723 |
522 |
357 |
230 |
3.21 |
8.96 |
|
0.574 |
681 |
695 |
706 |
–* |
0.48 |
-0.72 |
|
0.489 |
495 |
524 |
–* |
627 |
-0.17 |
-2.40 |
*Конформационный
переход не завершается при высоких a.
1.2. Кислотно-основные свойства
поли-1-винилазолов в водном растворе
Потенциометрические кривые титрования ПВИ и ПВТр раствором HCl лежат существенно
выше, чем для чистой кислоты при соответствующей концентрации в воде, что
указывает на присоединение протона к пиридиновому атому азота азольного кольца.
Кривые титрования растворов ПВИ и ПВТр в координатах pK сопряженной
кислоты – a (рис. 2) существенно
различаются. При увеличении степени депротонирования сопряженной кислоты ПВИ ее
рК монотонно возрастает. После ионизации ПВТр кислотой на 5-6% его основность
падает на 2-3 порядка.
|
|
|
|
Рис. 1. Кривые потенциометрического и вискозиметрического
титрования ПВТ, ПИПТ и сополимеров ИПТ с ВПд и стиролом (Ст).
Числа у кривых сополимеров соответствуют мол.д. ИПТ.
Данные получены при обратном титровании в среде 0.1 М NaCl. Концентрация
кислотных групп полимеров – 0.0075 моль/л |
|
 С другой
стороны, величины рКо отрыва последнего протона от сопряженных кислот
(Табл. 2), полученные экстраполяцией зависимости pK-a к a = 1,
достаточно близки для ПВИ и ПВТр. Относительно высокая основность
непротонированного ПВТр является неожиданной, учитывая значительное различие в
основности низкомолекулярных аналогов исследуемых ПВАз (pKa сопряженной
кислоты 1-этилимидазола 8.9, 1-этил-1,2,4-триазола – 4.3). Объяснить
этот факт можно, учитывая известные сведения [А.А.Тагер и др. Высокомол. соед. А. 1987. Т. 19. С. 2421] о донорно-акцепторных взаимодействиях между азольными
звеньями в ПВАз в конденсированном состоянии, которые более характерны для
ПВТр, чем для ПВИ. При растворении ПВТр небольшая часть этих связей сохраняется
и азольные звенья, выступающие в качестве акцепторов электронной плотности,
будут обладать повышенной основностью:
С другой
стороны, величины рКо отрыва последнего протона от сопряженных кислот
(Табл. 2), полученные экстраполяцией зависимости pK-a к a = 1,
достаточно близки для ПВИ и ПВТр. Относительно высокая основность
непротонированного ПВТр является неожиданной, учитывая значительное различие в
основности низкомолекулярных аналогов исследуемых ПВАз (pKa сопряженной
кислоты 1-этилимидазола 8.9, 1-этил-1,2,4-триазола – 4.3). Объяснить
этот факт можно, учитывая известные сведения [А.А.Тагер и др. Высокомол. соед. А. 1987. Т. 19. С. 2421] о донорно-акцепторных взаимодействиях между азольными
звеньями в ПВАз в конденсированном состоянии, которые более характерны для
ПВТр, чем для ПВИ. При растворении ПВТр небольшая часть этих связей сохраняется
и азольные звенья, выступающие в качестве акцепторов электронной плотности,
будут обладать повышенной основностью:
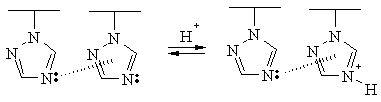
![Подпись:
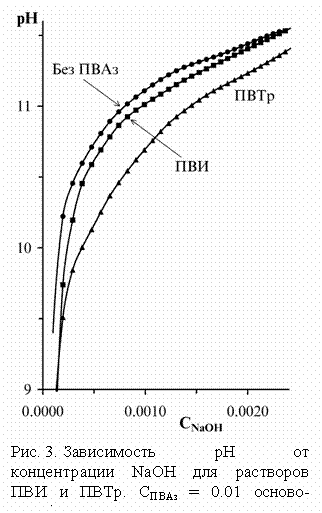
Рис. 2. Зависимость рК от степени ионизации сопряженных кислот ПВИ и ПВТр в присутствии различных концентраций NaCl. [ПВАз] = 0.1 осно-во-моль/л.](annenkov.files/image021.gif) При потенциометрическом титровании растворов ПВАз
растворами щелочей обнаружено понижение pH (рис. 3), указывающее на
взаимодействие азольных звеньев с гидроксильными анионами. Учитывая более
сильное проявление этого эффекта для ПВТр можно также предположить донорно-акцепторное
взаимодействие с p-системой гетероцикла:
При потенциометрическом титровании растворов ПВАз
растворами щелочей обнаружено понижение pH (рис. 3), указывающее на
взаимодействие азольных звеньев с гидроксильными анионами. Учитывая более
сильное проявление этого эффекта для ПВТр можно также предположить донорно-акцепторное
взаимодействие с p-системой гетероцикла:
 Потенциометрическое
титрование растворов низкомолекулярных аналогов (1-этилимидазола и
1-этил-1,2,4-триазола) щелочами не показывает различий по сравнению с чистым
раствором щелочи. Вероятно, дополнительная стабилизация структур, образующихся
при взаимодействии ПВАз с щелочами, обусловлена
компенсацией зарядов близлежащими звеньями, связанными с катионами.
Потенциометрическое
титрование растворов низкомолекулярных аналогов (1-этилимидазола и
1-этил-1,2,4-триазола) щелочами не показывает различий по сравнению с чистым
раствором щелочи. Вероятно, дополнительная стабилизация структур, образующихся
при взаимодействии ПВАз с щелочами, обусловлена
компенсацией зарядов близлежащими звеньями, связанными с катионами.
Координация азольных циклов с низкомолекулярными катионами и анионами
изучена с помощью спектроскопии ЯМР и УФ. Для ПВАз характерны мультиплетные
сигналы в спектрах 1Н и в спектрах 13С. При добавлении к раствору ПВТр эквимольного количества HCl происходит
сдвиг сигналов на 0.2-0.4 м.д. в спектрах 1Н и на 1-3 м.д. в спектрах 13С. Для ПВИ сдвиг сигналов более существенный: на
0.3-0.5 м.д. в спектрах 1Н и на 3-7 м.д. в спектрах 13С. Наибольшее смещение характерно для сигналов,
характеризующих азольный цикл. При добавлении NaOH к растворам ПВИ и ПВТр существенных
изменений в спектрах ЯМР не наблюдается.
Для азольных циклов при
изменении мольного соотношения [NaOH]/[ПВТр] от 0 до 5 максимум полосы
поглощения в УФ спектре, обусловленный p-p* переходом, смещается от 205 до 212 нм, а ее интенсивность
уменьшается приблизительно втрое. При добавлении щелочи к раствору ПВИ эффект изменения
полосы менее выражен, что обусловлено менее акцепторными свойствами p-системы гетероцикла ПВИ.
Таким образом, на
основании проведенных исследований становится очевидным взаимодействие азольных
циклов с кислотами и щелочами по различным реакционным центрам. Для ПВИ более
характерно, чем для ПВТр, протонирование пиридинового атома азота гетероцикла,
приводящее к более существенному перераспределению s-электронной плотности, проявляющемуся в спектрах ЯМР. С другой стороны,
взаимодействие гидроксид-анионов с p-системой азольного кольца более выражено в случае триазольного кольца,
чем для имидазольного, что и отражается в УФ спектрах.
1.3. Моделирование
кислотно-основного равновесия в растворах полимерных электролитов в рамках
теории "эффекта соседа"
В качестве удобного
метода для построения модели диссоциации слабых полимерных электролитов
использован одномерный подход Изинга, который достаточно широко применялся в
исследованиях кинетики полимераналогичных реакций (теория "эффекта
соседа"). Рассматривали влияние состояния соседних звеньев на константу
диссоциации данного звена в пределах пентад:

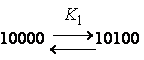

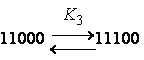
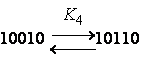


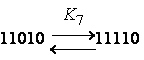
|
|
|
, где "0" – неионизованное звено, "1" – ионизованное. |
Как показано в [Вайнштейн Э.Ф., Берлин А.А.,
Энтелис С.Г. // Высокомол. соед. Сер. Б. 1975. Т. 17. С. 835.], из десяти констант
независимыми являются только 4, а остальные могут быть выражены через них:
K4 = K2K1/K0; K5 = K2K3/K1; K6 = K12/K0;
K7
= K32/K1; K8
= K1K3/K0; K9 = K33/(K1K2)
Моделирование
осуществлено методом Монте-Карло. На основе экспериментальных данных по
потенциометрическому титрованию полиакриловой кислоты вычисляли значения
индивидуальных констант диссоциации путем минимизации отклонений расчетных рН
от экспериментальных величин по методу центроида Бокса. Выбранная модель
удовлетворительно описывает кривые титрования при различных концентрациях ПАК и
ПВТ (стандартное отклонение менее 0,05). Анализ значений полученных констант
диссоциации позволил уменьшить число независимых параметров до двух (K1 и K0):
Возможность
моделирования диссоциации слабых полимерных кислот с использованием только двух
констант равновесия свидетельствует об аддитивном электростатическом влиянии
соседних заряженных звеньев на кислотно-основные свойства центрального звена.
 Значения
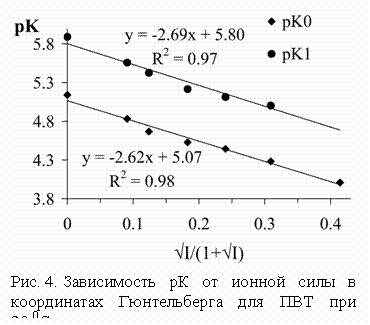
pK закономерно уменьшаются с увеличением ионной силы раствора (рис. 4).
При этом имеется линейная зависимость между pK и величиной
Значения
pK закономерно уменьшаются с увеличением ионной силы раствора (рис. 4).
При этом имеется линейная зависимость между pK и величиной ![]() в соответствии с
уравнением Гюнтельберга:
в соответствии с
уравнением Гюнтельберга:
![]() ,
,
где
n – число отрицательных зарядов на ионизующейся кислоте, A – константа
Дебая-Хюккеля (0,522 при 20 0С), I – ионная сила раствора.
Некоторые
полиэлектролиты, например ПИПТ и ПМАК, при ионизации претерпевают конформационный
переход из компактной конформации при малых a к развернутой при
повышении степени ионизации. Для компактной
конформации характерно электростатическое влияние удаленных групп на
кислотность рассматриваемого звена. Для его учета ввели параметр DGэл, соответствующий изменению свободной энергии ионизации
при нахождении ионизованного звена рядом с рассматриваемым.
Поскольку электростатическая энергия уменьшается пропорционально расстоянию, рК
для звена, входящего в компактную конформацию, вычисляли
как:
![]() ,
,
где рК0 находили,
исходя из анализа соседних звеньев, z -
число звеньев между рассматриваемым и ионизованным звеном. Суммирование ведется
по всем звеньям в пределах компактной конформации. Устойчивость
компактной конформации характеризовали величиной DGкп, равной энергии разрушения связи между двумя взаимодействующими
звеньями. Предположив, что разрушение компактной конформации
под действием электростатического отталкивания ионизованных групп происходит
кооперативно на участке между двумя заряженными звеньями, для свободной энергии
этого процесса имеем:
![]()
Здесь х –
число звеньев на разрушаемом участке компактной
конформации, а электростатический вклад рассчитывали по всем ионизованным
звеньям, взаимодействие между которыми прекращается при данном конформационном
переходе.
Обработка
данных для ПМАК и ПИПТ с учетом введенных параметров показала, что модель
удовлетворительно описывает экспериментальные кривые потенциометрического
титрования.
Таким образом, на основе
теории "эффекта соседа" построена математическая модель, позволяющая
количественно обрабатывать кривые потенциометрического титрования слабых
полиэлектролитов с использованием всего двух независимых параметров. Далее
разработанная методология будет применена при анализе интерполимерных систем.
2. Изучение
комплексообразования полимеров и сополимеров на основе карбоксил- и азолсодержащих мономеров с ионами переходных
металлов
Координационные соединения переходных металлов с карбоксилсодержащими полимерами достаточно хорошо описаны в литературе, но они по-прежнему вызывают интерес исследователей, поскольку даже в случае таких относительно простых макромолекул как ПАК и ПМАК строение образующихся комплексов определяется многими факторами – степенью нейтрализации кислотных групп, конформацией полимерных молекул, природой низкомолекулярных анионов при ионах металла. Поли-5-винилтетразолы, сопоставимые по кислотности с карбоновыми кислотами, содержат пиридиновые атомы азота, способные к донорно-акцепторным взаимодействиям с ионами металла. Особый интерес к комплексам азолсодержащих полимеров связан с их склонностью к внутри- и межмолекулярной ассоциации, при этом можно ожидать как конкуренции, так и синергизма между комплексообразованием и ассоциацией.
Целью данного раздела является изучение закономерностей взаимодействия ионов переходных металлов с рядом азолсодержащих полимеров в водных растворах. Большая часть исследований выполнена на ионах меди (II), что позволило использовать высокоинформативный метод ЭПР для изучения структуры комплексов. Учитывая известные общие закономерности в комплексообразовании ионов металлов с полимерами и определенную близость свойств тетразольных и карбоновых кислот первоначальные исследования выполнены с использованием карбоксильных поликислот.
2.1. Комплексообразование
полиметакриловой и полиакриловой кислот с ионами меди
 Детальное исследование взаимодействия ПМАК с
ионами Cu2+ методом потенциометрического титрования позволило
предположить образование компактных структур с повышенной концентрацией ионов
меди, стабилизация которых осуществляется за счет синергизма координационных,
водородных связей и гидрофобных взаимодействий боковых метильных групп:
Детальное исследование взаимодействия ПМАК с
ионами Cu2+ методом потенциометрического титрования позволило
предположить образование компактных структур с повышенной концентрацией ионов
меди, стабилизация которых осуществляется за счет синергизма координационных,
водородных связей и гидрофобных взаимодействий боковых метильных групп:
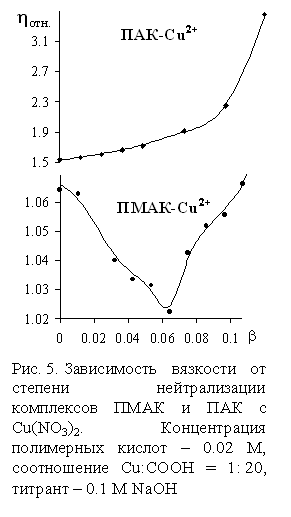
Формирование
подобных компактных структур приводит к минимуму на кривой зависимости вязкости
от b в системе ПМАК-Cu2+, в отличие от комплексов
с ПАК (рис. 5).
Особенности координации и распределения ионов
меди в полиакриловых кислотах изучали с помощью чувствительного и
информативного метода ЭПР. Исследовали твердые комплексы, полученные лиофильной
сушкой соответствующих растворов. Спектр ЭПР комплекса ПМАК-Cu2+
представляет из себя суперпозицию нескольких сигналов, принадлежащих различным
структурам, интенсивность которых зависит от концентрации ионов
Cu2+ в полимере. Используя прием компьютерного взаимного вычитания
экспериментальных спектров, принадлежащих различным концентрациям меди, было
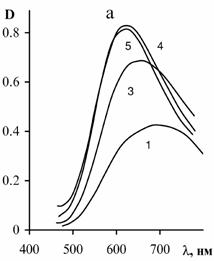
идентифицировано три типа индивидуальных сигналов, которые приведены на рис. 6.
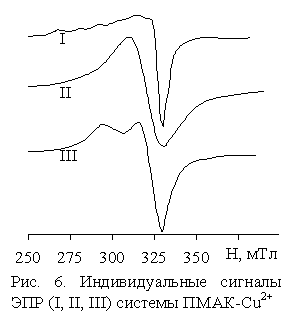
 Спектр
ЭПР I комплекса ПМАК-Cu2+ при соотношении Cu:COOH = 1:60 представляет
слабый асимметричный сигнал, характерный для тетрагональных соединений Cu2+.
Вследствие относительно большой ширины индивидуальной линии (DH = 8мТл) разрешается СТС от ядер меди только в
"параллельной части" спектра. Интенсивность этого сигнала соответствует
количеству ионов меди в металлополимере. С увеличением концентрации ионов меди до соотношения Cu:COOH = 1:20
интенсивность сигнала медленно нарастает и одновременно появляется широкий
симметричный сигнал II, интенсивность которого растет пропорционально концентрации
меди. При дальнейшем увеличении содержания меди в полимере
(Cu:COOH > 1:20) рост интенсивности сигнала I от тетрагональных
комплексов Cu2+ прекращается (наступает насыщение). При
соотношении Cu:COOH > 1:4 рост интенсивности симметричного сигнала
II также прекращается и появляется новый асимметричный сигнал III свободного
нитрата меди.
Спектр
ЭПР I комплекса ПМАК-Cu2+ при соотношении Cu:COOH = 1:60 представляет
слабый асимметричный сигнал, характерный для тетрагональных соединений Cu2+.
Вследствие относительно большой ширины индивидуальной линии (DH = 8мТл) разрешается СТС от ядер меди только в
"параллельной части" спектра. Интенсивность этого сигнала соответствует
количеству ионов меди в металлополимере. С увеличением концентрации ионов меди до соотношения Cu:COOH = 1:20
интенсивность сигнала медленно нарастает и одновременно появляется широкий
симметричный сигнал II, интенсивность которого растет пропорционально концентрации
меди. При дальнейшем увеличении содержания меди в полимере
(Cu:COOH > 1:20) рост интенсивности сигнала I от тетрагональных
комплексов Cu2+ прекращается (наступает насыщение). При
соотношении Cu:COOH > 1:4 рост интенсивности симметричного сигнала
II также прекращается и появляется новый асимметричный сигнал III свободного
нитрата меди.
Симметричный сигнал II принадлежит полиядерным ассоциатам (кластерам)
ионов Cu2+, образование которых по мере возрастания концентрации ионов меди в полимере происходит только после того, как
сформируются моноядерные тетрагональные комплексы Cu2+.
Наличие насыщения интенсивности сигналов I и II при соотношении Cu:COOH @ 1:20 и 1:4, соответственно, указывает на существование
предельной “емкости” полимера для формирования моноядерных тетрагональных
комплексов Cu2+ (сигнал I) и полиядерных ассоциатов (сигнал II).
При нейтрализации растворов ПАК и
ПМАК с помощью NaOH в процессе комплексообразования с ионами Cu2+
происходят структурные изменения металлополимера, зависящие от концентрации ионов Cu2+ и степени нейтрализации.
Уже при малой степени
нейтрализации ПМАК (b = 0.1) происходит разрушение полиядерных
кластеров и образование димеров Cu2+ , что проявляется в
исчезновении симметричного сигнала II и появление слабого сигнала IV в области
480 мТл, характерного для термически возбужденного триплетного состояния димера
карбоксилата меди (рис. 7).
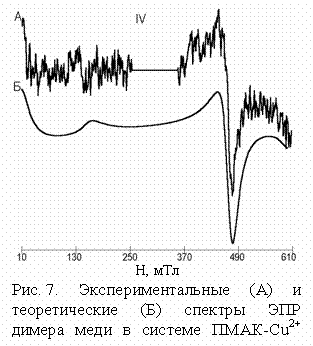 Дополнительной качественной характеристикой межионного
взаимодействия в полимерных комплексах может служить ширина спектральной линии
(рис. 8), измеренная в
"перпендикулярной" части спектра (~330 мТл): чем выше локальная концентрация ионов Cu2+, тем больше ширина линии, обусловленная
диполь-дипольным взаимодействием между ионами Cu2+.
Дополнительной качественной характеристикой межионного
взаимодействия в полимерных комплексах может служить ширина спектральной линии
(рис. 8), измеренная в
"перпендикулярной" части спектра (~330 мТл): чем выше локальная концентрация ионов Cu2+, тем больше ширина линии, обусловленная
диполь-дипольным взаимодействием между ионами Cu2+.
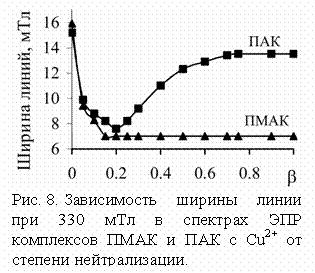 В
отсутствие нейтрализации ПАК и ПМАК комплекс находится, вероятно, в виде плотного
клубка, стабилизированного водородными связями между карбоксильными группами,
что приводит к сильному проявлению пространственных взаимодействий ионов Cu2+
(большая ширина линии ЭПР). При нейтрализации (до b = 0.2) ширина сигнала ЭПР начинает
уменьшаться, что указывает на увеличение расстояния между ионами меди за счет
разрушения слабых водородных связей между карбоксильными группами, после чего
макромолекула распрямляется, и ионы меди удаляются друг от друга.
В
отсутствие нейтрализации ПАК и ПМАК комплекс находится, вероятно, в виде плотного
клубка, стабилизированного водородными связями между карбоксильными группами,
что приводит к сильному проявлению пространственных взаимодействий ионов Cu2+
(большая ширина линии ЭПР). При нейтрализации (до b = 0.2) ширина сигнала ЭПР начинает
уменьшаться, что указывает на увеличение расстояния между ионами меди за счет
разрушения слабых водородных связей между карбоксильными группами, после чего
макромолекула распрямляется, и ионы меди удаляются друг от друга.
При дальнейшей
нейтрализации ширина сигнала в комплексах ПМАК не меняется. В системах с ПАК
при увеличении b (b > 0.2) образуются комплексы, содержащие 3-4
карбоксилатные группы в качестве лигандов с участием удаленных звеньев, что
обеспечивается достаточной гибкостью цепи ПАК. При этом
происходит сшивание макромолекулярного клубка за счет координационных связей,
приводящее к его компактизации и, следовательно, к сближению ионов и вновь к
образованию полиядерных ассоциатов (кластеров). Отсутствие подобного
эффекта в комплексах ПМАК может быть связано с большей жесткостью ее цепи и стерическими затруднениями со стороны боковых метильных
групп.
2.2. Комплексообразование
поли-5-винилтетразола с ионами меди и кадмия
ПВТ более склонен к образованию упорядоченных внутри- и межмолекулярных
водородных связей по сравнению с полиакриловыми кислотами. При его взаимодействии
с многозарядными ионами металлов можно было ожидать значительного проявления
взаимного усиления водородного и металло-координационного связывания.
Добавление
нитратов меди и кадмия к раствору ПВТ при b = 0.025[1] приводит к понижению рН. Кривые титрования
свидетельствуют об образовании комплексов ПВТ-М2+ состава 4: 1 в случае меди и
2: 1 для кадмия. При высоком содержании соли металла комплекс выпадает в
осадок за счет сшивания полимерных цепей ионами металла.
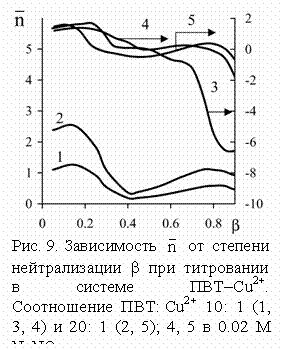 Кривые потенциометрического титрования комплексов растворами щелочей
лежат, как правило, ниже соответствующих кривых свободных кислот. Потенциометрические
данные преобразовывали в зависимость среднего числа карбоксильных групп, координированных
с ионом металла (
Кривые потенциометрического титрования комплексов растворами щелочей
лежат, как правило, ниже соответствующих кривых свободных кислот. Потенциометрические
данные преобразовывали в зависимость среднего числа карбоксильных групп, координированных
с ионом металла (![]() ) от b по модифицированному методу
Бьеррума (рис. 9). При этом в области низких b наблюдается довольно высокая координация,
несколько возрастающая при увеличении степени нейтрализации. Далее, после b = 0.2-0.4 величина
) от b по модифицированному методу
Бьеррума (рис. 9). При этом в области низких b наблюдается довольно высокая координация,
несколько возрастающая при увеличении степени нейтрализации. Далее, после b = 0.2-0.4 величина ![]() понижается, в некоторых случаях приближаясь к
нулю или даже опускаясь ниже. Полученные результаты существенно отличаются от
данных для полиакриловых кислот, в случае которых наблюдается повышение
понижается, в некоторых случаях приближаясь к
нулю или даже опускаясь ниже. Полученные результаты существенно отличаются от
данных для полиакриловых кислот, в случае которых наблюдается повышение ![]() с ростом b до значений 2-3.
с ростом b до значений 2-3.
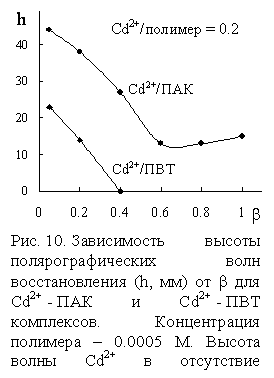 Обнаруженное уменьшение
Обнаруженное уменьшение ![]() в комплексах ПВТ может свидетельствовать о разрушении
комплексов. Для проверки этого предположения использовали метод полярографии. В
случае комплексов с ионами меди получены неоднозначные результаты, что связано
с наложением при некоторых b двух волн восстановления Cu2+.
Координация ионов Cd2+ с ПВТ приводит к
понижению высоты волны восстановления иона металла (h), а при b>0.4 полярографическая волна вообще не наблюдалась
(рис. 10). В системе ПАК-Cd2+ h также уменьшается при
возрастании b, но полярографическая волна сохраняется
при всех степенях ионизации, что свидетельствует о меньшей координации в
системе ПАК-Cd2+, чем в случае ПВТ. В то же время, по данным равновесного
диализа, в растворе ПВТ-Cd2+ присутствуют свободные
ионы металла в количестве 2% только при b = 0.025, повышение степени
нейтрализации приводит к полному связыванию ионов металла. Таким образом,
наблюдаемое понижение
в комплексах ПВТ может свидетельствовать о разрушении
комплексов. Для проверки этого предположения использовали метод полярографии. В
случае комплексов с ионами меди получены неоднозначные результаты, что связано
с наложением при некоторых b двух волн восстановления Cu2+.
Координация ионов Cd2+ с ПВТ приводит к
понижению высоты волны восстановления иона металла (h), а при b>0.4 полярографическая волна вообще не наблюдалась
(рис. 10). В системе ПАК-Cd2+ h также уменьшается при
возрастании b, но полярографическая волна сохраняется
при всех степенях ионизации, что свидетельствует о меньшей координации в
системе ПАК-Cd2+, чем в случае ПВТ. В то же время, по данным равновесного
диализа, в растворе ПВТ-Cd2+ присутствуют свободные
ионы металла в количестве 2% только при b = 0.025, повышение степени
нейтрализации приводит к полному связыванию ионов металла. Таким образом,
наблюдаемое понижение ![]() в комплексах ПВТ не может быть связано с их
разрушением при высоких b.
в комплексах ПВТ не может быть связано с их
разрушением при высоких b.
Наблюдаемые
отличия в поведении ПВТ и полиакриловых кислот при комплексообразовании с
ионами металлов могут быть связаны с наличием в ПВТ при
низких b двутяжных регулярных структур,
стабилизированных водородными и ионными связями. Внедрение M2+ в эти
структуры должно привести к образованию "смешанного" комплекса,
который будет достаточно устойчив при ионизации ПВТ, поскольку координационные
связи не разрушаются при повышении b:
 Взаимное усиление водородных,
ионных и координационных связей приводит к увеличению комплексообразующей
способности ПВТ при низких b. Кислотность NH протонов,
входящих в эти структуры, должна существенно понижаться по сравнению со свободным ПВТ. Этот эффект компенсирует понижение рН при
увеличении координации ионов металла с полимером.
Очевидно, в данном случае метод Бьеррума плохо применим к описанию
комплексообразования, потому что он основан на допущении о постоянстве
кислотности свободных звеньев при переходе от чистого полимера к комплексу.
Взаимное усиление водородных,
ионных и координационных связей приводит к увеличению комплексообразующей
способности ПВТ при низких b. Кислотность NH протонов,
входящих в эти структуры, должна существенно понижаться по сравнению со свободным ПВТ. Этот эффект компенсирует понижение рН при
увеличении координации ионов металла с полимером.
Очевидно, в данном случае метод Бьеррума плохо применим к описанию
комплексообразования, потому что он основан на допущении о постоянстве
кислотности свободных звеньев при переходе от чистого полимера к комплексу.
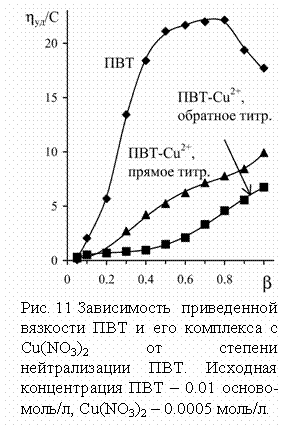 Вискозиметрическое исследование системы ПВТ – Cu2+ (рис. 11)
показывает, что в присутствии 5 мол. % ионов меди увеличение размера полимерной цепи при ионизации
существенно меньше, чем для чистого полимера. Следует отметить, что при
обратном титровании комплекса поливинилтетразолят натрия – медь коллапс полимерных
цепей происходит при более высокой степени нейтрализации (≈0.5), чем их разворачивание в ходе прямого
титрования (≈0.2). Очевидно, при прямом
титровании локализация ионов меди в отдельных частях комплекса оставляет другие
участки цепей свободными и они могут участвовать в
полиэлектролитном набухании. С другой стороны, равномерное распределение
металла при полной ионизации ПВТ приводит к связыванию в комплекс всех цепей, в
области полунейтрализации это способствует сворачиванию макромолекул.
Вискозиметрическое исследование системы ПВТ – Cu2+ (рис. 11)
показывает, что в присутствии 5 мол. % ионов меди увеличение размера полимерной цепи при ионизации
существенно меньше, чем для чистого полимера. Следует отметить, что при
обратном титровании комплекса поливинилтетразолят натрия – медь коллапс полимерных
цепей происходит при более высокой степени нейтрализации (≈0.5), чем их разворачивание в ходе прямого
титрования (≈0.2). Очевидно, при прямом
титровании локализация ионов меди в отдельных частях комплекса оставляет другие
участки цепей свободными и они могут участвовать в
полиэлектролитном набухании. С другой стороны, равномерное распределение
металла при полной ионизации ПВТ приводит к связыванию в комплекс всех цепей, в
области полунейтрализации это способствует сворачиванию макромолекул.
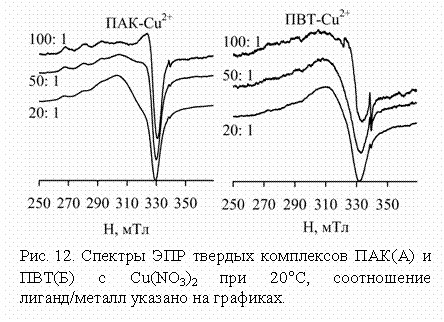
Тенденция к локализации
меди в отдельных участках цепей ПВТ подтверждается данными ЭПР тетрагональных
комплексов (Рис. 12-14). Спектр ЭПР комплекса ПВТ с Cu2+ в отсутствии нейтрализации
представляет типичный асимметричный сигнал, в котором вследствие диполь-дипольного уширения линий практически не проявляется
СТС даже в "параллельной" части спектра. Характер спектров
не изменяется даже при соотношении ПВТ: Cu2+ = 100: 1, тогда
как в аналогичных комплексах ПАК диполь-дипольное
уширение сигнала не наблюдается уже при соотношении 50: 1 (рис. 12).
![]()
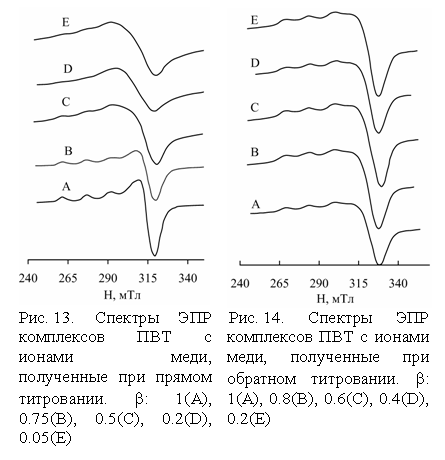
 При нейтрализации комплекса NaOH (прямое титрование) при низких и средних b сигнал имеет характерное уширение
(Рис. 13, кривые C-E), связанное с диполь-дипольными взаимодействиями ионов Cu2+, находящихся
на близком расстоянии друг от друга. Очевидно, данные спектры относятся к
"смешанным" комплексам, в которых локальная концентрация меди весьма
высока. Только при высоких степенях нейтрализации двутяжные структуры начинают
разрушаться и в спектрах проявляется СТС вследствие уменьшения локальной концентрации ионов Cu2+ (A║ = 160×10-4 cм-1; g║
= 2.256, g^ = 2.008). Спектры образцов (Рис. 14, кривые A-E), полученных при обратном
титровании, практически не зависят от b и соответствуют изолированным
ионам меди, что связано с невозможностью образования "смешанного"
комплекса в области высоких b и ионы металла равномерно распределяются
вдоль цепей ПВТ, не образуя областей повышенной локальной концентрации.
При нейтрализации комплекса NaOH (прямое титрование) при низких и средних b сигнал имеет характерное уширение
(Рис. 13, кривые C-E), связанное с диполь-дипольными взаимодействиями ионов Cu2+, находящихся
на близком расстоянии друг от друга. Очевидно, данные спектры относятся к
"смешанным" комплексам, в которых локальная концентрация меди весьма
высока. Только при высоких степенях нейтрализации двутяжные структуры начинают
разрушаться и в спектрах проявляется СТС вследствие уменьшения локальной концентрации ионов Cu2+ (A║ = 160×10-4 cм-1; g║
= 2.256, g^ = 2.008). Спектры образцов (Рис. 14, кривые A-E), полученных при обратном
титровании, практически не зависят от b и соответствуют изолированным
ионам меди, что связано с невозможностью образования "смешанного"
комплекса в области высоких b и ионы металла равномерно распределяются
вдоль цепей ПВТ, не образуя областей повышенной локальной концентрации.
 Таким образом, при взаимодействии Cu2+ и Cd2+ с
ПВТ ионы металлов включаются в двутяжные участки полимера, что сопровождается
их стабилизацией и увеличением координации ионов с
тетразольными звеньями.
Таким образом, при взаимодействии Cu2+ и Cd2+ с
ПВТ ионы металлов включаются в двутяжные участки полимера, что сопровождается
их стабилизацией и увеличением координации ионов с
тетразольными звеньями.
2.3. Комплексообразование
сополимера акриловой кислоты и 1-винилимидазола с ионами меди (II)
Сополимер АК с ВИ
содержит кислотные карбоксильные группы и азольные циклы, способные проявлять
слабые основные свойства и образовывать водородные связи с электронодефицитными
атомами водорода. Наличие внутримолекулярных водородных и ионных связей
приводит к нерастворимости сополимера в воде. При повышении pH раствора эти
связи частично разрушаются, а появление отрицательного заряда на полимерной
цепи способствует разворачиванию макромолекулярных клубков и растворению
сополимера. В то же время, при неполной нейтрализации кислотных групп возможно их взаимодействие со звеньями ВИ в растворе,
что должно сказываться на кислотных и координационных свойствах сополимеров. В
работе использован сополимер АК-ВИ, содержащий 0.28 мол.д.
звеньев ВИ.
Кривая титрования
сополимера АК-ВИ в координатах pK – степень ионизации лежит ниже
кривой чистой ПАК, что может быть связано с частичным подавлением электростатического
эффекта при ионизации звеньев АК, разделенных звеньями ВИ. Учитывая известные
константы сополимеризации этих мономеров (rВИ
= 0.02, rАК = 0.24), можно предположить, что сополимер состоит из
одиночных звеньев ВИ и коротких (2-3 звена) блоков АК. В то же время, для
сополимеров характерен участок падения pK с ростом степени ионизации. Повышение
кислотности в этой области вызвано, вероятно, разрушением внутримолекулярных
водородных и ионных связей между звеньями АК и ВИ.
Аналогичный вид имеют
кривые титрования и при использовании KOH и LiOH для нейтрализации сополимеров.
В последнем случае кривая несколько смещена в кислую
область, что согласуется с большей способностью ионов Li+
конденсироваться на цепях поликислот. Кроме того, можно предположить
возможность замещения протона ионом лития в водородных связях между звеньями АК
и ВИ, что также должно повышать кислотность сополимера:
Взаимодействие сополимера с ионами Cu2+ в растворе
сопровождается понижением рН (рис. 15), причем на кривых для степеней
нейтрализации 0.6 и 1 можно отметить участки, соответствующие образованию
комплексов различного состава. Область насыщения сополимера ионами Cu2+
сдвигается в область больших количеств меди при повышении степени нейтрализации
сополимера.
Кривые
потенциометрического титрования полимеров и их комплексов растворами щелочей существенно
различаются для ПАК и
сополимера АК-ВИ (рис. 16). В случае ПАК наблюдается понижение рН раствора
комплекса во всем интервале b, тогда как для сополимера
характерен меньший сдвиг кривых в присутствии металла и сближение кривых
титрования в области b ≈ 0.4. Это явление
могло быть связано с меньшей устойчивостью комплексов сополимера, в связи чем они были изучены методом равновесного диализа.
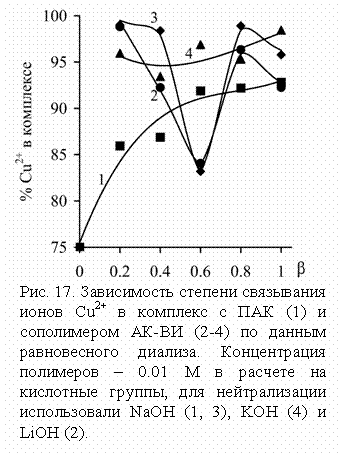
Полученные результаты (рис. 17) указывают на существенно
большую стабильность комплексов сополимера АК-ВИ. В
системе с ПАК высокая степень связывания ионов Cu2+ (>90%)
наблюдается лишь при высоких b, а в
более кислой области комплекс частично разрушается. В случае сополимера
комплекс практически не диссоциирует при низких и высоких степенях
нейтрализации, но частично распадается в области b = 0,6 при нейтрализации
растворами LiOH и NaOH.
![Подпись:
Рис. 15. Кривые титрования сопо-лимера АК-ВИ раствором CuCl2. [COOH] = 0.0075 М, титранта – 0.1 М. Степень нейтрализации сополимера: 0.2 (1), 0.6 (2), 1.0 (3).](annenkov.files/image086.gif) Повышенная устойчивость этих комплексов при малых b и меньшее понижение рН при их образовании по
сравнению с комплексами ПАК может быть связано с преимущественным комплексообразованием
с имидазольными звеньями.
Для уточнения центров координации в сополимерах АК-ВИ проведены спектральные
исследования в УФ и видимой области, а также методом ЭПР.
Повышенная устойчивость этих комплексов при малых b и меньшее понижение рН при их образовании по
сравнению с комплексами ПАК может быть связано с преимущественным комплексообразованием
с имидазольными звеньями.
Для уточнения центров координации в сополимерах АК-ВИ проведены спектральные
исследования в УФ и видимой области, а также методом ЭПР.
Введение ионов меди в растворы ПАК и поли-1-винилимидазола (ПВИ)
приводит к изменениям в УФ спектрах. В случае ПАК появляется полоса комплекса в
области 250 нм, а для ПВИ наблюдается некоторое увеличение интенсивности его
полосы поглощения при 209 нм. Добавление к сополимеру АК-ВИ ионов Cu2+
не изменяет вид спектра в области поглощения азольных звеньев, но вызывает
появление полосы при 250-270 нм, которую можно отнести к комплексу меди с
карбоксильными группами.
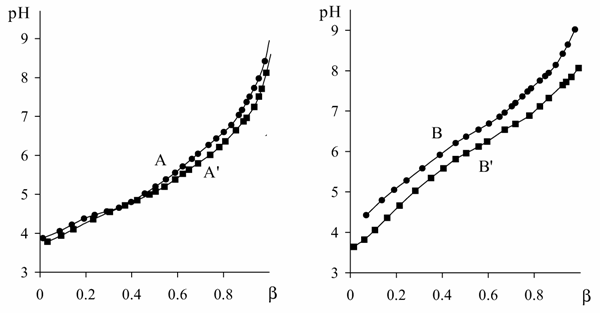
Рис. 16. Кривые
титрования сополимера АК-ВИ (А), ПАК (B) и их комплексов с ионами Cu2+
(A', B'). Концентрация полимеров – 0.01 М в расчете на кислотные звенья, CuCl2
– 0.0005 М.
Растворы
исследуемого сополимера и соответствующих гомополимеров оптически прозрачны в
видимой области, а их комплексы с ионами меди имеют характерные спектры
поглощения (рис. 18). В случае
ПВИ при увеличении его концентрации полоса смещается от 695 к 620 нм. Для
комплексов ПАК наблюдается поглощение при 710-715 нм, причем оно ослабевает с
увеличением соотношения ПАК: Cu2+ при постоянной концентрации
меди.
 Эта
необычная концентрационная зависимость может быть связана с кооперативным
характером взаимодействия ионов меди с полимерами, который
особенно ярко проявляется при высоких b, когда
электростатическое набухание цепи препятствует образованию
высококоординированных комплексов. Повышение содержания Cu2+ до
определенного предела приводит к большей ее координации за счет компенсации отрицательного
заряда цепи и меньших потерь в энтропии при взаимодействии ионов
металла с уже частично сшитыми участками макромолекул. При
этом возможно образование димерных и полимерных комплексов, обладающих большим
поглощением в видимой области [Leyte J.C. // Kolloid-Z. und Z. Polymere.
1966. V. 212. P. 168.].
Эта
необычная концентрационная зависимость может быть связана с кооперативным
характером взаимодействия ионов меди с полимерами, который
особенно ярко проявляется при высоких b, когда
электростатическое набухание цепи препятствует образованию
высококоординированных комплексов. Повышение содержания Cu2+ до
определенного предела приводит к большей ее координации за счет компенсации отрицательного
заряда цепи и меньших потерь в энтропии при взаимодействии ионов
металла с уже частично сшитыми участками макромолекул. При
этом возможно образование димерных и полимерных комплексов, обладающих большим
поглощением в видимой области [Leyte J.C. // Kolloid-Z. und Z. Polymere.
1966. V. 212. P. 168.].
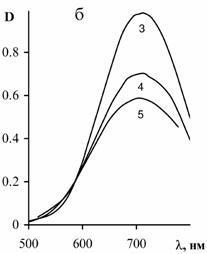
Интенсивность
поглощения комплексов сополимера практически не зависит от его концентрации,
при ее уменьшении наблюдается смещение полосы поглощения от 675 к 710 нм.
Дальнейшее понижение концентрации сополимера приводит к выпадению его в осадок.
Таким образом, при избытке звеньев АК (20: 1) в комплексообразовании
участвуют как звенья АК, так и ВИ. Уменьшение количества сополимера в комплексе
сдвигает равновесие в сторону карбоксилатного комплекса, что согласуется с
отмеченным выше поведением комплексов ПАК-Cu2+.
Спектры ЭПР комплексов
меди (II) с сополимером АК-ВИ имеют вид, характерный для тетрагональных
комплексов меди. Параметры спектров (табл. 3) сопоставлялись с
соответствующими данными для комплексов ПАК.

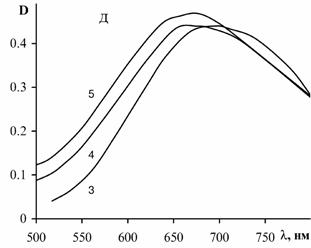
Рис. 18. Спектры
поглощения медных комплексов ПВИ (а), ПАК (б, в) и сополимера АК-ВИ (г, д). Степень
нейтрализации звеньев ПАК: 0.8 (б, г) и 1.0 (в, д). Концентрация CuCl2
– 0.0025 моль/л, полимерных звеньев – 0.00625 (1),
0.01 (2), 0.0125 (3), 0.025 (4), 0.05 (5). Толщина кюветы – 50 мм.
Таблица 3.
Параметры спектров ЭПР комплексов ПАК и
сополимера АК-ВИ с ионами Сu2+ (CuCl2, соотношение [звенья полимера]: [Cu2+] = 20: 1)
|
Лиганд |
b |
A║×104 cм-1 |
A┴×104 cм-1 |
g║ |
g┴ |
|
ПВИ |
– |
170.7 |
– |
2.271 |
2.025 |
|
ПАК-Cu(NO3)2,
NaOH |
0.15 |
135 |
|
2.343 |
2.039 |
|
ПАК, NaOH |
1 |
154.4 |
27.8 |
2.345 |
2.058 |
|
ПАК, NaOH, диализ |
1 |
153.8 |
19.3 |
2.335 |
2.060 |
|
0.8 |
153.8 |
19.3 |
2.335 |
2.060 |
|
|
0.6 |
153.8 |
19.3 |
2.335 |
2.061 |
|
|
0.4 |
153.8 |
19.3 |
2.335 |
2.060 |
|
|
0.2 |
154.2 |
– |
2.340 |
2.035 |
|
|
0 |
143.6 |
– |
2.325 |
2.040 |
|
|
Сополимер АК-ВИ, NaOH, лиганд: Cu2+ =
100: 1 |
1 |
171.1 |
– |
2.276 |
2.022 |
|
Сополимер АК-ВИ, NaOH |
1 |
153.7 |
– |
2.333 |
2.048 |
|
0.8 |
153.7 |
– |
2.333 |
2.048 |
|
|
0.6 |
153.7 |
– |
2.333 |
2.048 |
|
|
0.4 |
153.7 |
– |
2.332 |
2.050 |
|
|
0 |
153.7 |
– |
2.333 |
2.046 |
|
|
Сополимер АК-ВИ, NaOH, диализ |
1 |
154.0 |
22.5 |
2.337 |
2.056 |
|
0.8 |
154.1 |
22.6 |
2.339 |
2.058 |
|
|
0.6 |
154.1 |
– |
2.339 |
2.060 |
|
|
0.4 |
154.1 |
– |
2.339 |
2.037 |
|
|
0.2 |
173.3 |
– |
2.306 |
2.042 |
|
|
Сополимер АК-ВИ, KOH |
1 |
153.8 |
19.3 |
2.334 |
2.061 |
|
0.8 |
153.8 |
19.3 |
2.334 |
2.060 |
|
|
0.6 |
153.8 |
19.3 |
2.334 |
2.060 |
|
|
0.4 |
172.2 |
– |
2.295 |
2.034 |
|
|
Сополимер АК-ВИ, LiOH |
1 |
172.0 |
– |
2.304 |
2.045 |
|
Сополимер АК-ВИ, LiOH, диализ |
1 |
163.9 |
– |
2.297 |
2.036 |
|
0.8 |
164.0 |
– |
2.299 |
2.036 |
|
|
0.6 |
164.0 |
– |
2.299 |
2.036 |
|
|
0.4 |
164.5 |
– |
2.306 |
2.038 |
|
|
0.2 |
164.5 |
– |
2.306 |
2.036 |
Прежде всего следует отметить существенные
отличия в случае комплексов ПАК с хлоридом и нитратом меди. В системе с CuCl2
получены спектры с хорошо разрешенной сверхтонкой структурой в параллельной и
перпендикулярной ориентации (рис. 19), в то время как для нитратных
комплексов СТС║ разрешается только при b = 0.2 (рис. 20). По-видимому,
ионы хлора, являющиеся более сильными лигандами по сравнению с NO3‑,
несколько понижают координационную активность ионов меди, и образование
координационно-сшитых структур с высокой локальной концентрацией металла в
случае CuCl2 не происходит. Для комплексов карбоксильных полимеров с
Cu2+ известны структуры, имеющие от одной до четырех карбоксильных
групп, координированных с ионом меди. Для рассматриваемых нами систем более
вероятна координация не более чем с двумя кислотными группами, так как большая
степень координации потребовала бы значительной компактизации полимерного
клубка, что привело бы к уширению спектральных линий. Параметры комплекса ПАК с
CuCl2 (табл. 3) при b = 0
отличаются от таковых для других комплексов с хлоридом меди и приближаются к
нитратному комплексу. По-видимому, в этой области ионы хлора могут
удаляться в ходе лиофильной сушки по реакции:

Спектры ЭПР комплексов меди (II) с сополимером АК-ВИ имеют вид, характерный
для тетрагональных комплексов меди с достаточно хорошо разрешенной сверхтонкой
структурой в параллельной ориентации, а в ряде случаев и в перпендикулярной.
При рассмотрении параметров спектров (Табл. 3) можно выделить три группы
комплексов. Характеристики первой из них (A║ ≈ 154×10-4 см-1; g║
= 2.335 – 2.345) совпадают с таковыми для комплекса ПАК. В этих спектрах хорошо
разрешается параллельная составляющая СТС, а линии СТС в "перпендикулярной"
области достаточно узки (2-3 мТл). Исходя из этого можно
предположить, что ионы меди в данных комплексах распределены достаточно
равномерно вдоль полимерной цепи.
Вторая группа
комплексов по параметрам спектров ЭПР близка к комплексу ПВИ с Cu2+ (A║
= 170.7×10-4 см-1; g║ = 2.271), в
спектрах этих комплексов не разрешается СТС в "перпендикулярной" области.
Комплексы такого типа отмечаются при низких степенях нейтрализации, при большом
избытке сополимера и при использовании LiOH для нейтрализации карбоксильных
групп. Очевидно, во всех этих случаях активность карбоксильных
звеньев понижена за счет протонирования при малых b, электростатических эффектов в области высоких b, конденсации ионов Li+ на карбоксилатных
анионах.
Частичное удаление
литиевых катионов в ходе диализа приводит к комплексам с параметрами,
промежуточными по отношению к рассмотренным выше спектрам, не изменяющимися в
широком интервале степеней нейтрализации. Ширина линий СТС при этом больше
константы СТС, вследствие чего в "перпендикулярной" области линии СТС
не разрешаются, свидетельствуя об относительной компактности комплекса.
Вероятно, в этом случае образуется смешанный комплекс меди (II), включающий карбоксильные
группы и имидазольные звенья.
Таким образом,
спектральные исследования взаимодействия сополимера АК-ВИ с ионами Cu2+
свидетельствуют о преимущественной координации иона
металла с остатками АК, имидазольные звенья участвуют в реакции лишь при
ослаблении активности карбоксильных групп.
|
|
|
|
Рис. 19. Спектры ЭПР комплексов ПАК с CuCl2 при
различных степенях нейтрализации NaOH (приведены на графике), после диализа.
Отношение кислотные группы: Cu2+ = 20: 1. |
Рис. 20. Спектры ЭПР комплексов
сополимеров АК-ВИ (72% АК) с Cu(NO3)2 (А, Б) и CuCl2
(В, Г) при степени нейтрализации 1 (NaOH), после диализа (А) и без диализа
(Б-Г). Отношение кислотные группы: Cu2+ = 20: 1 (А-В) и 100: 1
(Г). |
В целом, учитывая
отмеченную выше возможность структурирования макромолекул сополимера АК-ВИ за
счет водородных, ионных и координационных связей с участием иона щелочного
металла и экспериментальные данные по комплексообразованию, можно предложить
следующую схему взаимодействия в системе сополимер – Cu2+:
-
при высоких степенях нейтрализации макромолекулы АК-ВИ находятся в развернутой
конформации и их комплексообразование с медью протекает аналогично ПАК. Внутренняя сфера комплекса включает 1-2
близлежащих остатка АК, звенья ВИ реагируют только при ослаблении активности
карбоксильных групп в условиях сильного электростатического набухания цепи или
конденсации ионов щелочных металлов;
-
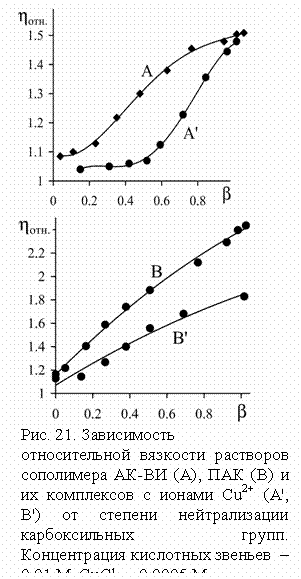 понижение
степени нейтрализации сопровождается значительной компактизацией макромолекул
комплекса, более сильной в случае сополимера, чем у
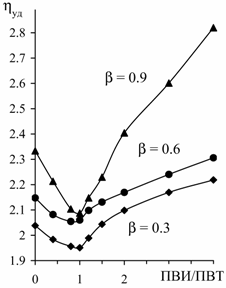
ПАК, о чем свидетельствуют вискозиметрические данные (рис. 21). Вероятно, связи
посредством ионов меди благоприятствуют проявлению других механизмов ассоциации
– водородных и ионных связей, координации через ион щелочного металла. Стабилизация
водородных связей с участием ~COOH групп понижает их кислотность и частично
компенсирует уменьшение рН при комплексообразовании, приводя к неприменимости
традиционных потенциометрических методов к подобным системам. Несмотря на
синергетический характер этих взаимодействий, существует, очевидно, конкуренция
между Сu2+ и ионами Na+ или Li+ за связывание
с полимерной цепью, что приводит к уменьшению координации меди в области b = 0.6, когда компактизация макромолекулы
комплекса близка к пределу, но количество карбоксилатов щелочного металла
достаточно велико. Отсутствие данного эффекта в случае ионов
K+ объясняется их меньшей координационной способностью;
понижение
степени нейтрализации сопровождается значительной компактизацией макромолекул
комплекса, более сильной в случае сополимера, чем у
ПАК, о чем свидетельствуют вискозиметрические данные (рис. 21). Вероятно, связи
посредством ионов меди благоприятствуют проявлению других механизмов ассоциации
– водородных и ионных связей, координации через ион щелочного металла. Стабилизация
водородных связей с участием ~COOH групп понижает их кислотность и частично
компенсирует уменьшение рН при комплексообразовании, приводя к неприменимости
традиционных потенциометрических методов к подобным системам. Несмотря на
синергетический характер этих взаимодействий, существует, очевидно, конкуренция
между Сu2+ и ионами Na+ или Li+ за связывание
с полимерной цепью, что приводит к уменьшению координации меди в области b = 0.6, когда компактизация макромолекулы
комплекса близка к пределу, но количество карбоксилатов щелочного металла
достаточно велико. Отсутствие данного эффекта в случае ионов
K+ объясняется их меньшей координационной способностью;
-
дальнейшее
уменьшение b сопровождается окончательным сжатием клубков комплекса,
вытеснением ионов щелочного металла в раствор и практически полным связыванием
ионов меди.
2.4. Комплексообразование сополимеров
1-винил-4,5,6,7-тетрагидроиндола и малеиновой кислоты с ионами переходных
металлов
 Полимеры, содержащие пиррольные циклы в боковой
цепи, являются крайне перспективными объектами благодаря высокой реакционной
способности и биологической активности таких структур. С этой точки зрения
представляет интерес изучение водорастворимых сополимеров одного из наиболее
доступных мономеров N-винилпиррольного ряда – 1-винил-4,5,6,7-тетрагидроиндола
(ВТГИ). Нами изучены координационные свойства сополимеров ВТГИ с малеиновой кислотой
(МК).
Полимеры, содержащие пиррольные циклы в боковой
цепи, являются крайне перспективными объектами благодаря высокой реакционной
способности и биологической активности таких структур. С этой точки зрения
представляет интерес изучение водорастворимых сополимеров одного из наиболее
доступных мономеров N-винилпиррольного ряда – 1-винил-4,5,6,7-тетрагидроиндола
(ВТГИ). Нами изучены координационные свойства сополимеров ВТГИ с малеиновой кислотой
(МК).
При исследовании взаимодействия сополимеров
ВТГИ-МК с хлоридами меди, кадмия, кобальта и марганца методом потенциометрического
титрования выявлены области кажущегося уменьшения координации металлов,
которые, как и в случае рассмотренных выше систем, можно отнести к компактным
структурам в макромолекулах комплексов, в которых кислотность свободных
карбоксильных групп понижена за счет водородных связей и электростатических
эффектов.
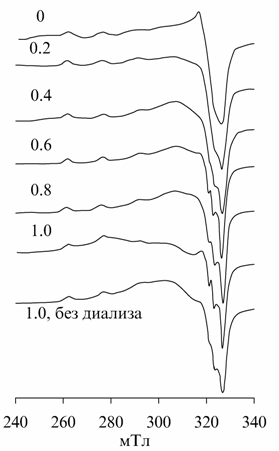
Спектры
ЭПР комплексов ионов меди с сополимерами ВТГИ-МК имеют вид, характерный для
тетрагональных комплексов (рис. 22). При высоком содержании Cu2+ в комплексе (кривая А1)
спектр имеет характерное уширение линий, свидетельствующее о близком
расположении атомов меди в пространстве и возможности их диполь-дипольного
взаимодействия. При уменьшении количества металла спектры приобретают вид,
свойственный системам с изолированными ионами меди, для которых становится
возможным определить параметры спин-гамильтониана (g║ = 2.313, g^ = 2.049, А║ = 134×10-4 cм-1). Параметры ЭПР
близки к таковым для комплексов ПАК с Cu2+, то есть в комплексе сополимера ВТГИ-МК с Cu2+ координационная сфера ионов меди состоит из атомов
кислорода.
При нейтрализации карбоксильных групп щелочью вид спектров ЭПР не изменяется
вплоть до b = 0.5 (рис. 22, кривые B), после чего линии сигнала
сужаются, указывая на увеличение расстояния между ионами Cu2+. Изменения ширины линий СТС в
спектрах ЭПР согласуются с высказанным нами ранее предположением о преимущественной
концентрации ионов в компактных областях сополимеров, после разрушения
которых атомы металла равномерно распределяются вдоль цепи сополимера.
|
|
Рис. 22. Спектры ЭПР комплексов полимеров
с CuCl2. А – комплексы сополимера
ВТГИ-МК при b=0 и соотношении звенья МК: CuCl2 = 10:1 {А1),
20:1 (А2) и 50:1 (А3); В - комплексы сополимера ВТГИ-МК при соотношении
звенья МК: CuCl2 = 10:1 и b = 0.874 (В1),
0.624 (В2), 0.50 (В3), 0.37 (В4) и 0 (В5). |
Исследуемые
сополимеры представляют собой короткие последовательности звеньев МК (2-4
звена), разделенные единичными звеньями ВТГИ. В сополимерах ВТГИ-МК в изучаемой
области рН происходит ионизация только половины карбоксильных групп, что
характерно для систем на основе МК. Таким образом, при высоких степенях нейтрализации в блоках МК
содержится 2-4 ионизованные карбоксильные группы, что достаточно для
комплексообразования только с одним атомом металла, и ионы меди оказываются
разделенными звеньями ВТГИ, что делает невозможными диполь-дипольные
взаимодействия между ними.
Сближению ионов при высоких b препятствует также низкая гибкость цепи сополимера,
связанная с большим количеством полярных (звенья МК) и объемных (ВТГИ) боковых
групп. Диполь-дипольное
взаимодействие ионов возможно лишь при низких степенях нейтрализации, когда
сополимер находится в компактной конформации и ионы металла, связанные с
различными блоками МК, могут сблизиться в пространстве.
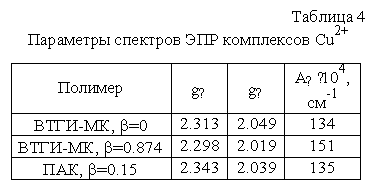 Рассмотрение параметров спектров ЭПР, в которых проявляется СТС, показывает
(табл. 4), что при увеличении b сополимеров от 0 до 0.87
понижается величина g║ и возрастает константа СТС А║, приближаясь к таковой для
комплекса ПАК с CuCl2 ( g║ = 2.345, А║ = 154.4×10-4 cм-1). Например, при b = 0.87 параметры ЭПР для комплекса сополимера
ВТГИ-МК с Cu2+ составляют: g║ = 2.298, А║ = 151.9×10-4 cм-1. Эти данные позволяют утверждать, что при повышенных
степенях нейтрализации ионы хлора входят во внутреннюю
сферу комплекса, как и в случае системы с ПАК. При b = 0 ионы хлора также могут удаляться в ходе
лиофильной сушки.
Рассмотрение параметров спектров ЭПР, в которых проявляется СТС, показывает
(табл. 4), что при увеличении b сополимеров от 0 до 0.87
понижается величина g║ и возрастает константа СТС А║, приближаясь к таковой для
комплекса ПАК с CuCl2 ( g║ = 2.345, А║ = 154.4×10-4 cм-1). Например, при b = 0.87 параметры ЭПР для комплекса сополимера
ВТГИ-МК с Cu2+ составляют: g║ = 2.298, А║ = 151.9×10-4 cм-1. Эти данные позволяют утверждать, что при повышенных
степенях нейтрализации ионы хлора входят во внутреннюю
сферу комплекса, как и в случае системы с ПАК. При b = 0 ионы хлора также могут удаляться в ходе
лиофильной сушки.
Таким образом, систематические исследования
процесса комплексообразования азол- и карбоксилсодержащих
полимеров и сополимеров с ионами металлов (преимущественно с медью) в водных
растворах и изучение строения образующихся комплексов в зависимости от степени
нейтрализации раствора позволили выявить некоторые общие закономерности
комплексообразования в представленном ряду водорастворимых полимеров и
сополимеров. Прежде всего, все исходные (не нейтрализованные) комплексы
полимеров и сополимеров с Cu2+
отличаются высокой локальной концентрацией ионов меди с ярко выраженным диполь-дипольным магнитным взаимодействием между ними в этих
ассоциатах.
При малых степенях
нейтрализации (b < 0.2) в чисто
карбоксилатных комплексах Cu2+
(комплексы с полиакриловой и полиметакриловой кислотами) происходит упорядочение
в ассоциатах и усиление обменных взаимодействий, в результате чего образуются
диамагнитные димеры с термически заселенным возбужденным триплетным состоянием. Дальнейшее увеличение степени нейтрализации
(0.2 < b < 1) приводит к
разрушению димеров с образованием плоско-квадратных моноядерных комплексов,
равномерно распределенных вдоль полимерной цепи в случае ПМАК, или с
образованием новых ассоциатов с высокой локальной концентрацией ионов Cu2+ в случае ПАК.
Повышение степени нейтрализации
кислотных групп увеличивает их координационную активность, что проявляется в
комплексообразовании сополимеров АК-ВИ с ионами меди (II). При
низких значениях b образуются, в
основном, комплексы с азольными звеньями, а при высоких – карбоксилатные.
При использовании CuCl2 вместо Cu(NO3)2 в качестве исходной соли меди в комплексообразовании
реализуется возможность вхождения исходного ацидолиганда в координационную
сферу комплекса меди с полимером.
В случае полимеров, способных к
внутри- и межмолекулярному структурированию за счет водородных и ионных связей,
координационные связи с ионами Cu2+ могут дополнительно стабилизировать эти структуры.
2.5. Исследование особенностей структуры полимерных азолов и
металлокомплексов методом радиолиза
Используя высокоэффективный
метод деструкции твердых полимеров (рентгеновские лучи) и высокоселективный
метод идентификации парамагнитных центров (ЭПР) удалось выявить некоторые
особенности молекулярной структуры изначально диамагнитных веществ.
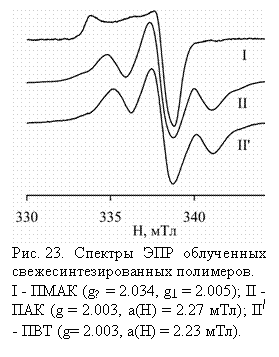 При
облучении в инертной атмосфере синтезированной в гексане ПМАК был
зарегистрирован интенсивный асимметричный сигнал I (рис. 23), характерный
для свободных радикалов, у которых неспаренный электрон локализован на атоме кислорода
(кислородный радикал). В отличие от ПМАК, в полимерах ПАК и ПВТ в аналогичных
условиях зарегистрированы углеродные свободные радикалы, в спектрах ЭПР которых
разрешается сверхтонкая структура (СТС) от двух эквивалентных протонов (сигналы
II и II/, соответственно, рис. 23). Сравнительно высокая ширина линий в триплете
указывает на наличие неразрешенной дополнительной СТС. Сигналы II и II/ оставались неизменными при комнатной температуре
в течение 1-2 часов, что убедительно указывает регистрацию парамагнитных
частиц, стабилизированных в объеме полимеров. Поскольку условия синтеза для
ПМАК и ПАК одинаковы, а образующиеся свободные радикалы принципиально различны,
можно предположить, что источником кислородных радикалов в ПМАК являются сами
карбоксилатные группы. На этом основании кислородному радикалу приписывается
структура (1), а триплетным сигналам II и II/ – свободные радикалы типа (2) и (2'):
При
облучении в инертной атмосфере синтезированной в гексане ПМАК был
зарегистрирован интенсивный асимметричный сигнал I (рис. 23), характерный
для свободных радикалов, у которых неспаренный электрон локализован на атоме кислорода
(кислородный радикал). В отличие от ПМАК, в полимерах ПАК и ПВТ в аналогичных
условиях зарегистрированы углеродные свободные радикалы, в спектрах ЭПР которых
разрешается сверхтонкая структура (СТС) от двух эквивалентных протонов (сигналы
II и II/, соответственно, рис. 23). Сравнительно высокая ширина линий в триплете
указывает на наличие неразрешенной дополнительной СТС. Сигналы II и II/ оставались неизменными при комнатной температуре
в течение 1-2 часов, что убедительно указывает регистрацию парамагнитных
частиц, стабилизированных в объеме полимеров. Поскольку условия синтеза для
ПМАК и ПАК одинаковы, а образующиеся свободные радикалы принципиально различны,
можно предположить, что источником кислородных радикалов в ПМАК являются сами
карбоксилатные группы. На этом основании кислородному радикалу приписывается
структура (1), а триплетным сигналам II и II/ – свободные радикалы типа (2) и (2'):

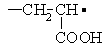
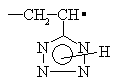
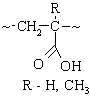
(1) (2) (2')
СТС сигналов II и II/ обусловлена сверхтонким
взаимодействием (СТВ) неспаренного электрона с двумя протонами, находящимися в a- и b- положениях. Второй из b- протонов не взаимодействует с неспаренным
электроном, поскольку он расположен в плоскости радикального центра.
Необходимо подчеркнуть,
что в выбранных условиях облучения (t = 25°C) регистрируются только вторичные радикалы радиолиза,
которые стабилизируются в объеме полимера. Существенным отличием ПМАК от ПАК и ПВТ является наличие
боковых метильных групп, что обусловливает различия в структуре
макромолекулярных клубков этих полимеров. При синтезе ПМАК в углеводородной среде,
гидрофильные карбоксильные группы, очевидно, локализуются во внутренних
областях клубков, обеспечивая контакт гидрофобных метильных групп с гексаном. В
этом случае в полимере создаются области с повышенной концентрацией
кислородсодержащих групп, способствующих формированию кислородных радикалов. С
другой стороны, основная цепь ПАК менее гидрофобна и явления структурирования
для нее менее характерны.
Если
облучению подвергнуть полимеры, предварительно выделенные из воды и высушенные
на воздухе, то в случае ПАК и ПВТ вновь регистрируются те же самые сигналы II и
II/. В случае же ПМАК появляется вместо асимметричного сигнала I
симметричный мультиплет, который можно рассматривать как суперпозицию по
крайний мере трех сигналов: сигнала - квинтета IIIa с биноминальным распределением
интенсивностей 1:4:6:4:1 от
четырех эквивалентных протонов с константой СТС а(H) = 2.23 мТл; сигнала -
секстета IIIb с равноотстоящими друг от друга линиями на расстоянии 2.23 мТл;
слабого сигнала IIIc, линии СТС которого регистрируются в промежутках между
интенсивными линиями сигналов IIIа и IIIb (рис. 24).
Сигнал III соответствует макрорадикалу типа:
Мультиплет из пяти линий обусловлен взаимодействием неспаренного электрона
с тремя эквивалентными протонами свободно вращающейся метильной группы и одним
протоном метиленовой группы. Второй протон метиленовой группы не участвует в
сверхтонком взаимодействии, что указывает на расположении его в плоскости
радикального центра.
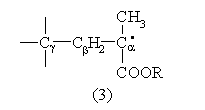 Регистрация
трех сигналов - мультиплетов в нашем случае связана, вероятно, с одновременным
существованием трех конформеров радикала (3), отличающихся друг от друга
пространственным расположением протонов метиленовой группы относительно p-обитали, занятой
неспаренным электроном. Предельные структуры конформеров, качественно
отвечающие сигналам IIIа, IIIb и IIIс, соответственно
можно представить в виде:
Регистрация
трех сигналов - мультиплетов в нашем случае связана, вероятно, с одновременным
существованием трех конформеров радикала (3), отличающихся друг от друга
пространственным расположением протонов метиленовой группы относительно p-обитали, занятой
неспаренным электроном. Предельные структуры конформеров, качественно
отвечающие сигналам IIIа, IIIb и IIIс, соответственно
можно представить в виде:
|
3a 3b 3c |
где углеродные атомы Сa и Сb лежат на одной линии, перпендикулярной
плоскости листа. |
На рис. 24 приведены
расчетные спектры ЭПР трех модельных структур, отвечающих наиболее точному
визуальному их совпадению с экспериментальным спектром а также суммарный спектр
IIId с весовыми коэффициентами IIIа: IIIb: IIIс = 10:2:1. Расчетные константы СТС равны:
IIIа: а(3Н) = 2.23 мТл;
а(1Н) = 2.23 мТл; а(1Н) = 0 мТл
IIIb:
а(3Н) = 2.23 мТл; а(1Н) = 4.46 мТл; а(1Н) = 2.23 мТл
IIIс: а(3Н) = 2.23 мТл;
а(1Н) = 1.11 мТл; а(1Н) = 1.11 мТл
Подводя итог
выполненных исследований структуры свободных радикалов в зависимости от способа
подготовки образцов к анализу, необходимо констатировать, что выделение ПМАК из
воды приводит к перестройке молекулярной структуры полимера: гидрофобная часть
полимера локализуется во внутренней части полимерного клубка, а гидрофильная
часть переходит на периферию. В отличие от ПМАК, полимеры ПАК и ПВТ еще на
стадии синтеза из неводных растворов принимают подобную
структуру и поэтому выделение их из воды не отражается на природе
стабилизированных радикалов.
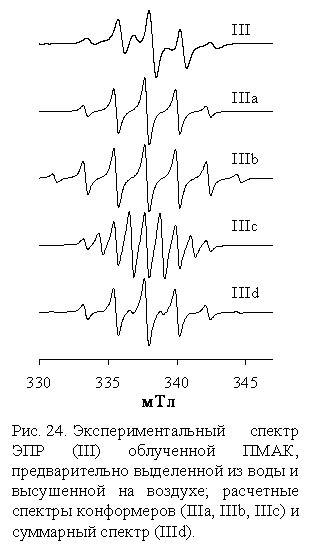 Если
облучению подвергнуть ПМАК, в которую предварительно
введены ионы Cu2+ в количестве Cu: СООН>1: 10,
то свободнорадикальные сигналы ЭПР не регистрируются; наблюдается только характерный
сигнал от карбоксилатного комплекса Cu2+. Свободнорадикальный сигнал
III слабой интенсивности удается зарегистрировать только при уменьшении
концентрации ионов Cu2+ в ПМАК (Cu: СООН<1: 10).
Следует отметить, что в этих условиях регистрируется индивидуальный сигнал IIIb
без примесей сигналов IIIа и IIIс. Кроме того,
облучение приводит к незначительному уменьшению интенсивности сигнала от Cu2+
за счет частичного восстановления Cu2+ до
диамагнитного Cu1+.
Если
облучению подвергнуть ПМАК, в которую предварительно
введены ионы Cu2+ в количестве Cu: СООН>1: 10,
то свободнорадикальные сигналы ЭПР не регистрируются; наблюдается только характерный
сигнал от карбоксилатного комплекса Cu2+. Свободнорадикальный сигнал
III слабой интенсивности удается зарегистрировать только при уменьшении
концентрации ионов Cu2+ в ПМАК (Cu: СООН<1: 10).
Следует отметить, что в этих условиях регистрируется индивидуальный сигнал IIIb
без примесей сигналов IIIа и IIIс. Кроме того,
облучение приводит к незначительному уменьшению интенсивности сигнала от Cu2+
за счет частичного восстановления Cu2+ до
диамагнитного Cu1+.
В отличие от ионов Cu2+,
ионы Co2+ и Ni2+, введенные в ПМАК в таких же количествах,
практически не снижают радиационный выход свободных радикалов, но регистрируется
также в основном сигнал IIIb. Кроме того, наблюдается некоторое
уширение линий СТС сигнала IIIb при высоких концентрациях ионов (M2+: СООН>1: 10),
свидетельствующее о магнитном взаимодействии между свободными радикалами и
ионами переходных металлов. Следовательно ионы
Co2+ и Ni2+ в ПМАК не вступают в окислительно-восстановительные
реакции со свободными радикалами, по крайней мере, при комнатной температуре.
2.6. Изучение
механизма каталитического окисления фенолов на медно-кобальтовых полимерных
комплексах
Изучение механизма
каталитического окисления комплексами переходных металлов показывает, что их
роль во многих случаях сводится к инициированию радикальных цепей и к ускорению
автоокисления. Несмотря на существенный прогресс в исследовании механизма жидкофазных
реакций каталитического окисления углеводородов, остаются неясными многие
детали этих процессов. Как показано в предыдущей главе, ионы переходных металлов
активно взаимодействуют со свободными макрорадикалами, образующимися в массе
полимера при радиолизе. В этой связи можно ожидать проявления окислительно-восстановительной
активности этих комплексов в типично радикальной реакции – окислении фенолов.
Выбор орто-замещенных
фенолов в качестве объекта исследования обусловлен, с одной стороны, полнотой
сведений о продуктах превращения реакционных частиц – феноксильных радикалов, с
другой стороны, высокой стабильностью этих радикалов в растворе, позволяющей в
реальном времени следить за кинетикой их превращения.
После добавления к толуольному раствору
2,4,6-три-трет-бутилфенола (ТБФ) в атмосфере аргона исходного (не
нейтрализованного) комплекса ПМАК-Cu2+ (СООН: Cu2+ = 10:1) и интенсивного перемешивания
смеси не удалось зафиксировать образования свободных
радикалов в температурном интервале 333¸371 К. Отсутствовали
сигналы ЭПР от свободных радикалов и при использовании слабо нейтрализованных
комплексов ПМАК-Cu2+ (b < 0.4). Лишь только при степени
нейтрализации b = 0.4 был зафиксирован сигнал ЭПР от
феноксильного радикала.
Интенсивность сигнала от радикала ТБФ росла с увеличением степени нейтрализации
b и достигла максимального значения при b = 1. Влияние степени нейтрализации полимера на
процесс образования свободных радикалов можно объяснить с точки зрения
представлений о смещении равновесия. Действительно, по причине высокой
кислотности ненейтрализованного комплекса ПМАК-Cu2+ равновесие в адсорбированном ТБФ будет смещено влево:
 Поскольку ТБФ реагирует с катионом меди (II) в
фенолятной форме, то уменьшение ее концентрации, очевидно, и приводит к падению
вероятности одноэлектронного переноса:
Поскольку ТБФ реагирует с катионом меди (II) в
фенолятной форме, то уменьшение ее концентрации, очевидно, и приводит к падению
вероятности одноэлектронного переноса:
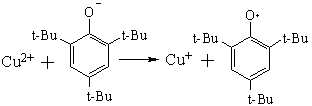 Если вместо ТБФ использовать
2,6-ди-трет-бутил-4-метилфенол (ДБМФ), то в аналогичных условиях не удается
зарегистрировать свободные радикалы, что согласуется с большим потенциалом
ионизации ДБМФ.
Если вместо ТБФ использовать
2,6-ди-трет-бутил-4-метилфенол (ДБМФ), то в аналогичных условиях не удается
зарегистрировать свободные радикалы, что согласуется с большим потенциалом
ионизации ДБМФ.
Если вместо комплекса
ПМАК-Cu2+ использовать комплекс ПМАК-Co2+ при тех же
условиях, то свободные радикалы не образуются при взаимодействии его как с
ДБМФ, так и с ТБФ. Следовательно, окислительно-восстановительный потенциал
карбоксилата кобальта (II) в металлополимере существенно ниже потенциалов пространственно-затрудненных
фенолов ТБФ и ДБМФ. Несколько неожиданными оказались данные
по взаимодействию ТБФ с медно-кобальтовым полимерным комплексом (соотношение
[СООН]:[Cu2+]:[Cо2+] =
10:0,5:0,5): феноксильные радикалы практически не регистрировались даже при
высоких степенях нейтрализации.
С целью выяснения влияния ионов Cо2+
на феноксильные радикалы, образующиеся в процессе окисления ТБФ на
медно-кобальтовом металлополимере, было исследовано взаимодействие индивидуальных
комплексов Со(II) с феноксильными радикалами ТБФ и
ДБМФ, предварительно синтезированными в анаэробных условиях окислением соответствующих
замещенных фенолов с помощью MnO2.
После добавления
полностью нейтрализованного (b = 1) комплекса ПМАК-Co2+ к
толуольному раствору феноксильных радикалов (ТБФ или ДБМФ) происходит быстрое
падение интенсивности сигнала ЭПР от этих радикалов и уширение линий СТС
вследствие частичного закрепления свободных радикалов на твердофазном комплексе.
С целью улучшения разрешения СТС и выяснения принципиальной возможности
связывания ионами кобальта (II) феноксильных радикалов
были проведены опыты по взаимодействию феноксильных радикалов с раствором бис-ацетилацетоната кобальта (II).
После добавления феноксильных радикалов к толуольному раствору Co(acac)2
наблюдается быстрое падение интенсивности сигнала от феноксильных радикалов и
появление нового сигнала, в котором разрешается СТС от одного ядра кобальта. Каждая
из восьми линий СТС от ядра кобальта (ICo = 7/2) дополнительно расщепляется на
несколько линий, число которых зависит от природы
феноксильного радикала. В случае ТБФ дополнительная
СТС представляет дублет с константой расщепления а(1Н) = 0.38 мТл (рис. 25); в
случае ДБМФ - квинтет с распределением интенсивностей 1:4:6:4:1 от четырех
практически эквивалентных протонов с такой же константой расщепления (рис. 25).
|
ДБМФ ТБФ |
|
||||
|
Рис. 25. Экспериментальный (а) и модельный (б) спектры ЭПР
радикалов ТБФ и ДБМФ с Co(acac)2 в толуольном растворе |
|||||
Анализ СТС спектров ЭПР позволяет приписать их
комплексам Co(III) следующей структуры:
|
|
где X=t-Bu (ТБФ), Me (ДБМФ); R-соответствующий феноксильный радикал |
Дополнительная СТС
обусловлена метиленовым протоном H* и (в случае ДБМФ) метильными протонами
группы X.
Образование
металлорганических комплексов Co(III) указывает на последовательное протекание
следующих реакций:
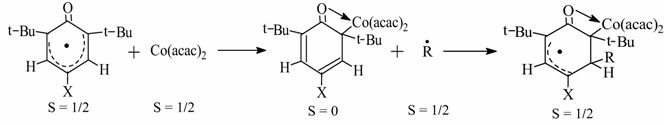
Согласно предлагаемой схеме,
вначале происходит окислительное присоединение феноксильного радикала R· к иону кобальта с образованием связи Co-C, которая предопределяет низкоспиновое состояние
иона Co(III) в образовавшемся
октаэдрическом комплексе, а затем - присоединение феноксильного
радикала R· к сопряженной диеновой структуре по мета
- положению к атому кислорода.
С целью обеспечения большей доступности свободных радикалов к ионам кобальта
(II) в полимере была предпринята попытка путем частичного
замещения карбоксилатных групп на ацетилацетонатные группы в комплексе ПМАК-Co2+
увеличить растворимость металлополимера в толуоле. В результате был
получен полимерный комплекс состава (~СОО)Со(acac), который
по-прежнему хорошо растворим в воде, и имеет удовлетворительную растворимость в
толуоле.
В ИК- спектре смешанного комплекса кобальта с
ацетилацетоном и ПМАК присутствуют полосы поглощения, относящиеся к
ацетилацетонатному фрагменту (768, 925, 1020, 1260, 1400, 1460, 1516 и 1590 см-1)
и звеньям ПМАК (1180 и 1700 см-1). При взаимодействии феноксильных
радикалов с полимерным комплексом Co2+ смешанного состава в растворе
толуола наблюдаются такие же спектры ЭПР, как и в случае Co(acac)2.
3. Интерполимерные
комплексы азолсодержащих полимеров
3.1. Комплексы
поли-5-винилтетразолов с ПААм, ПЭГ и ПВПд
ПВТ и ПИПТ образуют водорастворимые ИПК с такими слабыми полиоснованиями как
ПААм, ПЭГ и ПВПд. Устойчивость комплексов изменяется в ряду ПААм > ПЭГ >
ПВПд. Пониженная активность ПВПд, несопоставимая с его
высокой реакционноспособностью в комплексообразовании с полимерными карбоновыми
кислотами, связана со стерическими затруднениями при взаимодействии амидной
группы, окруженной метиленовыми группами, с объемным тетразольным кольцом.
Нейтрализация кислотных групп приводит к разрушению водородных связей и
распаду ИПК. На основе данных по потенциометрическому титрованию комплексов с
ПААм определили степени связывания кислотных групп (q и q' – в расчете
на звенья в кислотной форме, рис. 26). Следует отметить различный ход кривых q - b для ПИПТ и ПВТ. В первом случае комплекс относительно
устойчив до b = 0.2-0.3, а при более высоких степенях
нейтрализации быстро разрушается. Степень связывания кислотных групп в системах
ПВТ-ПААм понижается более равномерно, причем даже при b = 0.8 20-30% звеньев в N-H форме координированы
со звеньями ПААм.
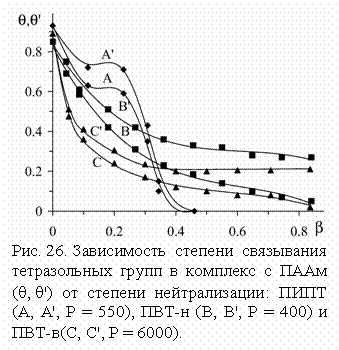 Повышенная
устойчивость комплексов при b = 0 связана, очевидно, с
их дополнительной стабилизацией за счет гидрофобных взаимодействий углеводородных
групп основных цепей, приводящих к компактизации интерполимерных частиц. Нейтрализация
тетразольных звеньев вызывает появление заряженных участков макромолекул и
разрушение компактных структур. Гидрофобная стабилизация более выражена в
случае ПИПТ, имеющего боковые метильные группы, и его комплексы более устойчивы
к ионизации, но при накоплении заряда на цепи разрушаются в узкой области b, соответствующей области разрушения компактной
конформации в чистом ПИПТ. При более высоких степенях
нейтрализации, когда эффект дополнительной гидрофобной стабилизации
отсутствует, ПИПТ оказывается менее активен в комплексообразовании, чем ПВТ.
Причины этого не совсем ясны, очевидно они не связаны
со степенью полимеризации поликислоты, так как для двух образцов ПВТ получены
близкие данные. Вероятно, боковые метильные группы в цепи ПИПТ повышают жесткость
цепи и создают некоторые стерические затруднения при комплексообразовании.
Несмотря на явно невысокую величину этих факторов, они могут оказаться решающими,
учитывая повышенную чувствительность полимер-полимерных
реакций к структуре реагирующих макромолекул.
Повышенная
устойчивость комплексов при b = 0 связана, очевидно, с
их дополнительной стабилизацией за счет гидрофобных взаимодействий углеводородных
групп основных цепей, приводящих к компактизации интерполимерных частиц. Нейтрализация
тетразольных звеньев вызывает появление заряженных участков макромолекул и
разрушение компактных структур. Гидрофобная стабилизация более выражена в
случае ПИПТ, имеющего боковые метильные группы, и его комплексы более устойчивы
к ионизации, но при накоплении заряда на цепи разрушаются в узкой области b, соответствующей области разрушения компактной
конформации в чистом ПИПТ. При более высоких степенях
нейтрализации, когда эффект дополнительной гидрофобной стабилизации
отсутствует, ПИПТ оказывается менее активен в комплексообразовании, чем ПВТ.
Причины этого не совсем ясны, очевидно они не связаны
со степенью полимеризации поликислоты, так как для двух образцов ПВТ получены
близкие данные. Вероятно, боковые метильные группы в цепи ПИПТ повышают жесткость
цепи и создают некоторые стерические затруднения при комплексообразовании.
Несмотря на явно невысокую величину этих факторов, они могут оказаться решающими,
учитывая повышенную чувствительность полимер-полимерных
реакций к структуре реагирующих макромолекул.
3.2. Комплексы поли-N-винилазолов
с полимерными кислотами
При смешении растворов
полимерных кислот (ПАК, ПМАК, ПВТ или ПИПТ) и поли-N-винилазолов
выпадает белый осадок, представляющий собой ИПК, стабилизированный преимущественно
водородными связями.
Образование такого
комплекса сопровождается увеличением рН раствора. При добавлении раствора ПВИ к
растворам ПАК и ПМАК, а также в системе ПВТр-ПМАК наблюдалось повышение рН до
соотношения концентраций полимеров, равного 1. В случае прибавления раствора
ПВТр к раствору ПАК возрастание рН происходило и после точки эквивалентности,
но значительно меньше. Очевидно, в данном случае комплекс ПАК-ПВТр наименее
устойчив, что согласуется с меньшей основностью ПВТр и меньшей устойчивостью
Н-ИПК на основе ПАК.
Hерастворимые Н-ИПК образуются при степенях
нейтрализации ПК меньше bпред (табл. 5). Увеличение bпред находится в соответствии с уменьшением степени
конденсации катионов на цепи ПК в ряду Li+>Na+>K+>Et4N+. При добавлении низкомолекулярной соли
возрастает ионная сила раствора, что приводит к улучшению взаимодействия между
компонентами за счет усиления гидрофобных взаимодействий.
Таблица 5
Предельные степени нейтрализации поликислоты (bпред), ниже которых происходит образование нерастворимых Н-ИПК
|
Система |
Низкомолекулярный противоион |
|||||||
|
без низкомолекулярной соли |
Концентрация MCl = 0.4 моль/л |
|||||||
|
Li+ |
Na+ |
K+ |
Et4N+ |
Li+ |
Na+ |
K+ |
Et4N+ |
|
|
ПАК-ПВИ |
0.32 |
0.35 |
0.38 |
0.39 |
0.52 |
0.67 |
0.75 |
0.85 |
|
ПАК-ПВТр |
0.09 |
0.1 |
0.11 |
0.13 |
0.17 |
0.35 |
0.25 |
0.63 |
|
ПМАК-ПВИ |
0.16 |
0.27 |
0.28 |
- |
0.73 |
0.76 |
0.82 |
- |
|
ПМАК-ПВТр |
0.03 |
0.07 |
0.1 |
- |
0.2 |
0.24 |
0.29 |
- |
|
ПВТ-ПВИ |
0.39 |
0.46 |
0.48 |
- |
0.66 |
0.68 |
0.81 |
- |
|
ПВТ-ПВТр |
0.01 |
0.01 |
0.01 |
- |
0.11 |
0.12 |
0.12 |
- |
|
ПИПТ-ПВИ |
- |
0.13 |
- |
- |
- |
0.66 |
- |
- |
|
ПИПТ-ПВТр |
- |
0.01 |
- |
- |
- |
0.33 |
- |
- |
В
системе ПАК-ПВТр степень полимеризации ПВТр (P = 280-850) не влияет на bпред, но при увеличении молекулярной массы поликислотной матрицы
(2800-30000) нерастворимый осадок существует при более высоких значениях b. По-видимому, с ростом степени полимеризации ПК
увеличивается вероятность образования более длинных непрерывных
последовательностей недиссоциированных карбоксильных групп на макромолекулах
ПАК.
![Подпись:
Рис. 27. Микрофотография частиц комплекса ПВТ-ПВИ; время после смешивания 3 часа. СПВТ= 0.005 осново-моль/л.; [ПВИ]/[ПВТ] =1; PПВТ = 6000, PПВИ=750.](annenkov.files/image148.gif) Турбидиметрическое
титрование поликислот растворами ПВАз показало, что независимо от b повышение
мутности раствора наблюдается до молярного соотношения полимеров, равного 1. По
данным микроскопических исследований, частицы комплексов, образующиеся сразу
после смешения растворов полимеров, представляют собой глобулы с размером в
диаметре 1.5¸3 мкм. Процесс формирования ИПК на этом не
заканчивается и продолжается с образованием более сложных структур(рис. 27).
Турбидиметрическое
титрование поликислот растворами ПВАз показало, что независимо от b повышение
мутности раствора наблюдается до молярного соотношения полимеров, равного 1. По
данным микроскопических исследований, частицы комплексов, образующиеся сразу
после смешения растворов полимеров, представляют собой глобулы с размером в
диаметре 1.5¸3 мкм. Процесс формирования ИПК на этом не
заканчивается и продолжается с образованием более сложных структур(рис. 27).
Стабилизация комплекса
ПВИ с полимерными кислотами может осуществляться как за счет водородных, так и
ионных связей, учитывая достаточно высокую основность имидазольных циклов. Расширение
области существования нерастворимого комплекса при повышении
ионной силы свидетельствует о преобладающей роли водородных связей. В то
же время, по данным ИК-спектроскопии полученных осадков, в комплексе ПВИ-ПМАК
происходит относительное увеличение полосы поглощения карбоксилатной группы
(1500-1560 см-1),
что позволяет предположить наличие некоторого количества ионных связей. В ИК спектрах полученных комплексов не наблюдается полос,
характерных для четвертичного азота. Таким образом, водородные связи вносят основной
вклад в стабилизацию нерастворимых комплексов ПВАЗ с поликислотами.
При рассмотрении данных
по потенциометрическому титрованию комплексов ПВИ следует учитывать возможность
вовлечения имидазольных звеньев в кислотно-основное равновесие в растворе. С
этой целью проводили моделирование титрования смеси ПК-ПВИ с использованием
разработанного алгоритма в рамках теории "эффекта соседа". Значения
рН в системе ПВАз-ПК выше рН свободной ПК и модельной смеси ПК-ПВИ до bобр » 0.6¸0.9
для ПВИ и до bобр» 0.2¸0.4
для ПВТр (рис. 28). Повышение ионной
силы раствора при добавлении низкомолекулярной соли вызывает дополнительную
стабилизацию Н-ИПК и увеличение значения bобр.
Образование Н-ИПК в
области b >0.2 не может протекать обычным путем через
взаимодействие непрерывных последовательностей кислотных групп с цепью полиоснования,
так как при этих b существуют только одиночные кислотные группы, разделенные блоками
ионизованных звеньев. По-видимому, процесс комплексообразования протекает через несколько последовательно-параллельных реакций:
А. Первичное взаимодействие звена
полиоснования В с кислотной группой.
В. Присоединение к соседней ионизованной группе протона из раствора
и образование еще одной водородной связи.
С. Диссоциация одиночной кислотной группы.
Стадии В и С повторяются несколько раз, приводя к
увеличению длины последовательности кислотных групп, связанных в комплекс.
Стабилизация ИПК в области высоких b
связана с участием анионов ПК в комплексообразовании по двум возможным
механизмам (на примере ПАК):
|
образование донорно-акцепторной связи СОО– групп и p-системы
азольных гетероциклов: |
образование связи азольного цикла с карбоксилат-анионом через
мостиковый катион: |
|
|
|
|
Со стереохимической точки зрения, последняя структура аналогична
таковой с водородной связью, поэтому можно предполагать наличие смешанных
комплексов, в которых оба типа взаимодействий усиливают друг друга за счет
кооперативного эффекта: |
|
Таким
образом, в системе ПВАз‑ПК возможно существование различных комплексов в
равновесном состоянии:

Преобладание той или
иной структуры и характер изменения рН при комплексообразовании зависят от ряда
факторов:
• степени нейтрализации
ПК;
• природы и
концентрации низкомолекулярного катиона;
• химической структуры
ПК;
• донорных и
акцепторных свойств ПВАз.
|
|
|
|
Рис. 28. Зависимость рН растворов ПВИ(ПВТр)-ПВТ и ПВТ от b и природы
противоиона. СПВТ = 0.01 осново-моль/л; СПВАз/СПВТ = 1; PПВТ=600; PПВИ=750. |
|
Очевидно, при высоких
степенях ионизации ПК в основном существуют комплексы (1) и (4). В области
значений b » bобр должны образовываться комплексы со структурой (2). При значениях
b, при которых наблюдаются более высокие значения
рН для растворов ИПК по сравнению с раствором ПК, равновесие сдвигается в сторону
образования Н-ИПК (структура 3). При изменении природы катиона от Li+ к Et4N+ уменьшается связывание низкомолекулярного
противоиона с полианионом и способность выступать в качестве связывающего
мостика. При b>bобр это отражается на величине разности рН растворов
смеси полимеров и чистой поликислоты при одинаковых значениях b. В присутствии Et4N+ рН системы ПК-ПВАз меньше, чем при нейтрализации
ПК LiOH. При значениях b<bобр равновесие сдвигается в сторону образования Н-ИПК
(структура 3).
Участие триазольной p-системы во взаимодействии с тетразолят-анионом подтверждается данными УФ
спектроскопии (рис. 29). Полоса p-p* перехода азольных звеньев ПВТр смещается в
красную область при повышении степени нейтрализации ПВТ в комплексе. При b = 1 это смещение соответствует
уменьшению энергии перехода на 72 Дж/моль. В случае ПВИ существенных изменений
в спектре не наблюдалось.
Ярким подтверждением
включения катионов щелочных металлов в ИПК являются данные ИК-спектроскопии
образцов, полученных лиофильным высушиванием соответствующих растворов. В спектрах
ИПК, полученных при различных степенях нейтрализации ПК, сохраняются основные полосы
обоих полимеров. В то же время, при b = 0.2¸0.5 в присутствии низкомолекулярной соли
существенно увеличивается интенсивность полосы карбоксилатной группы
относительно карбоксильной по сравнению со спектрами ПК. Очевидно, в ходе
лиофильной сушки раствора происходит превращение Н-ИПК в ИПК, основанный на взаимодействии карбоксилатных анионов с
азольными звеньями. В присутствии MCl при этом выделяется хлористый водород,
который немедленно удаляется из сферы реакции:
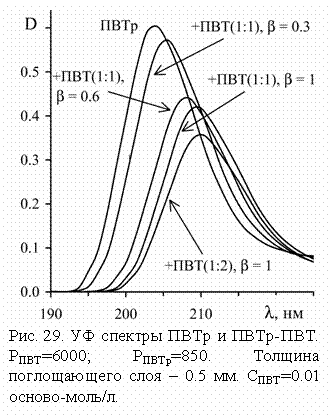 Выделяющийся
HCl обнаруживается по понижению рН воды, конденсирующейся при лиофильной сушке,
до значений 3¸4 и качественной реакцией на хлорид ион. Кроме
того, рН раствора ИПК, полученного растворением высушенного комплекса в воде,
повышается с 5¸7 до 7¸9
для ИПК при b = 0.2¸0.5
в присутствии NaCl.
Выделяющийся
HCl обнаруживается по понижению рН воды, конденсирующейся при лиофильной сушке,
до значений 3¸4 и качественной реакцией на хлорид ион. Кроме
того, рН раствора ИПК, полученного растворением высушенного комплекса в воде,
повышается с 5¸7 до 7¸9
для ИПК при b = 0.2¸0.5
в присутствии NaCl.
Взаимодействие двух
полимеров с образованием нового ассоциата сопровождается изменением размеров
макромолекулярных клубков и, следовательно, вязкости раствора (рис. 30).
Вязкость растворов ИПК до эквимольного соотношения концентраций незначительно увеличивается
или даже уменьшается независимо от b ПК. При
значениях [ПВАз]/[ПК] больше 1 вязкость резко возрастает. Наличие перегиба на
кривых зависимостей hуд-[ПВАз]/[ПК] подтверждает существование в системе
ПВАз-ПК одновременно нескольких типов ИПК, в образовании которых принимают
участие все карбоксильные и карбоксилатные группы. Значительное возрастание
вязкости после точки эквивалентности указывает на образование нестехиометрических
макромолекулярных агрегатов, то есть для данных систем принцип "все или
ничего" не реализуется.
Квантово-химические
расчеты модельных систем подтвердили возможность образования различных связей
N-винилазольных звеньев с кислотными группами (табл. 6). Расчет проведен с
использованием метода ZINDO/1, в качестве модельных соединений были выбраны
1-этилазолы и уксусная кислота. Образование водородной связи более выгодно с
имидазольным циклом, чем с триазольным. Меньшие  донорные свойства триазольной группы проявляются и в более низких
теплотах образования комплексов с участием ионов металла. Как и следовало ожидать, системы с Li+ более устойчивы, чем с Na+. Донорно-акцепторное взаимодействие карбоксилат
аниона с p-системой азольного кольца более выгодно в случае
триазольной группы, чем имидазольной.
донорные свойства триазольной группы проявляются и в более низких
теплотах образования комплексов с участием ионов металла. Как и следовало ожидать, системы с Li+ более устойчивы, чем с Na+. Донорно-акцепторное взаимодействие карбоксилат
аниона с p-системой азольного кольца более выгодно в случае
триазольной группы, чем имидазольной.
|
Рис. 30.
Зависимость hуд от j. PПВТ=6000;
PПВТр=850;
PПВИ=750;
CПВТ
=0.01 осново-моль/л. Нейтрализация раствором NaOH |
|
|
Ярким
подтверждением образования ИПК в данных системах при различных степенях
нейтрализации ПК служат данные дифференциальной сканирующей калориметрии (ДСК)
твердых образцов на основе ПВТ (рис. 31). Для ПВТ характерно разложение с
сильным экзотермическим эффектом в области 200-330ºС. При повышении b экзотермический пик сужается за счет
низкотемпературной части и появляется область эндотермического процесса при
200-270ºС.
ПВИ и ПВТр термически устойчивы в исследуемом интервале температур. Кривая ДСК
комплекса ПВТ-ПВИ при b = 0 аналогична
кривой для чистого ПВТ при b = 0.3, что может
свидетельствовать о наличии определенного количества ионных связей. В системе
ПВТ-ПВТр этот эффект менее выражен из-за меньшей основности триазольных звеньев.
Повышение степени ионизации приводит к постепенному исчезновению пиков,
характерных для ПВТ, и появлению в случае комплексов ПВИ эндотермического
эффекта при 300-360ºС, а в системе ПВТ-ПВТр к экзотермическому пику выше 350ºС. Различное влияние
ПВИ и ПВТр на поведение комплекса в условиях ДСК указывает на различный
характер взаимодействия в этих системах при высоких b. Образование комплекса с мостиковым ионом Na+
в случае ПВИ не должно приводить к значительным изменениям
электронной плотности в тетразолятных звеньях, а поэтому их разложение также протекает
с эндотермическим эффектом, хотя и происходит при более высоких температурах.
Оттягивание электронной плотности с тетразолят-анионов при взаимодействии с акцепторной
p-системой ПВТр приближает их состояние к звеньям в Н-форме и наблюдается
экзотермичный эффект, как и при b = 0.
|
|
|
Рис. 31. Кривые ДСК ПВТ, ПВАз и комплексов ПВТ-ПВАз. Скорость
нагрева – 10 град/мин. Нейтрализация раствором NaOH. |
3.3.
Термодинамические параметры интерполимерных реакций образования комплексов
поли-1-винилимидазола
Традиционные методы
вычисления степени связывания кислотных групп в ИПК, основанные на
сопоставлении потенциометрических данных для свободной поликислоты и комплекса,
непригодны в системах с ПВИ, который может протонироваться в водных растворах.
В этой связи для расчета термодинамических параметров комплексообразования
использовали одномерную модель ионизации полиэлектролита следующим образом:
-
на основе
данных по титрованию свободной поликислоты и ПВИ вычисляли последовательные константы
ионизации;
-
моделировали
титрование эквимольной смеси поликислоты и ПВИ при различных степенях связывания
кислотных групп, для чего соответствующую долю полимерных звеньев помечали как
недоступную для ионизации;
-
на основе
модельных кривых титрования строили зависимость pH от q при степени
нейтрализации, соответствующей одной из точек на экспериментальной кривой
потенциометрического титрования ИПК;
-
с помощью
полученной таким образом калибровочной кривой определяли степень связывания для
данной величины b и повторяли эту процедуру для других степеней
нейтрализации;
-
константы
устойчивости комплексов вычисляли по формуле:![]() , где С0 – исходная концентрация поликислоты, [HA] и [B]
– равновесные концентрации неионизованных кислотных и имидазольных звеньев. Для
нахождения [HA] и [B] производили расчет модельной системы при заданных q и b;
, где С0 – исходная концентрация поликислоты, [HA] и [B]
– равновесные концентрации неионизованных кислотных и имидазольных звеньев. Для
нахождения [HA] и [B] производили расчет модельной системы при заданных q и b;
-
свободную
энергию образования комплекса получали по известной формуле: ![]()
Полученные результаты
свидетельствуют о высокой устойчивости ИПК на основе ПВИ в растворе даже при
высоких степенях нейтрализации кислотных групп, так при b = 0.6-0.8 в комплекс связано до 50%
неионизованных кислотных звеньев. При высокой ионной силе комплексы при высоких b менее
стабильны, за исключением системы с ионами Li+, которые способны
замещать протон в водородно-связанных комплексах, стабилизируя их. Свободная энергия образования ИПК при высоких b находится в пределах 10-12 кДж/моль, что
соответствует DG взаимодействия карбоновых
кислот с этилимидазолом [Беляева
В.В., Скушникова А.И. и др. // Высокомол. соед. А. 1989.
Т. 31. С. 1988] и подтверждает предположение о взаимодействии
цепей путем одиночных контактов. При понижении степени нейтрализации
комплекс становится более прочным, как за счет энтропийных факторов, так и
стабилизации гидрофобными взаимодействиями. В области значений b, близких к нулю, DG
составляет »25 кДж/моль.
3.4. Взаимодействие поли-N-винилазолов с биологическими объектами
Изучение взаимодействия
белков с синтетическими полимерами представляет интерес с точки зрения
иммобилизации ферментов, стабилизации или разрушения их третичной структуры,
специфической сорбции белков на поверхностях, выявления механизмов
физиологической активности полимеров. В качестве биологических объектов были
выбраны бычий сывороточный альбумин, сыворотка крови человека и медицинский препарат
"Кодивак"[2].
Установлено, что БСА
образует с полиоснованиями интерполимерный комплекс за счет водородных связей с
участием кислотных групп белка, что сопровождается увеличением рН.
Потенциометрические кривые для растворов БСА, содержащих ПВИ, располагаются
значительно выше, чем в случае растворов БСА, содержащих ПВТр. При pH от 6 до
7.8 в системе ПВИ-БСА происходит фазовое разделение. Образуется белый мелкодисперсный
осадок, способный по истечении некоторого времени конгломерироваться в более
крупные частицы с образованием организованных надмолекулярных структур.
Растворение осадка происходит после добавления HCl в количестве,
соответствующем достижению изоэлектрической точки при титровании свободного
БСА. При этом кривая титрования комплекса сохраняет монотонный вид и
по-прежнему лежит выше кривой БСА. Понижение pH приводит к увеличению положительного
заряда на частицах комплекса и их растворению, а водородные связи между
звеньями ПВИ и БСА сохраняются. Повышение ионной силы
раствора практически не сказывается на взаимодействии БСА с ПВИ, а
комплексообразование с ПВТр усиливается.
Кривая
потенциометрического титрования раствора СКЧ имеет вид, характерный для
титрования слабого полиэлектролита. При добавлении к раствору СКЧ ПВАз кривые
потенциометрического титрования смещаются в основную область. В системе СКЧ-ПВИ
при рН = 6.5-8 наблюдается гетерофазное разделение.
"Кодивак"
растворяется в воде, образуя золевый раствор. При добавлении небольшого
количества HCl к раствору ПВИ-Кодивак гомогенность системы нарушается, образуется
мелкодисперсный осадок, при этом рН раствора выше, чем раствора чистого "Кодивака".
Способность ПВАз
образовывать ИПК с биополимерами открывает перспективы для разработки методов
фракционирования белков и выделения антигенов и антител.
4. Возможные области применения
азолсодержащих полимеров
Введение звеньев
винилазолов в полимерные материалы позволяет легко регулировать их кислотно-основные,
комплексообразующие свойства и гидрофобно-гидрофильный баланс. Эти продукты представляют
несомненный интерес в качестве сорбентов металлов [27, 33], матриц для
конструирования каталитических систем [42]. В данном разделе представлены
результаты исследования физиологической активности азолсодержащих полимеров[3].
При изучении острой
токсичности ПВТ, ПИПТ и сополимеров с ВПД (табл. 7) установлено, что
относительно низкомолекулярные полимеры нетоксичны, тогда как ПВТ высокой
молекулярной массы и сополимер 5ВТ-ВПД относятся к малотоксичным веществам.
Введение звеньев ВПД в поливинилтетразольную цепь понижает токсичность.
4.1. Антикоагулянтная активность
полимеров 5-изопропенилтетразола
Исследование влияние нетоксичных полимеров ИПТ на процесс гемокоагуляции
(табл. 8) указывает на достаточно высокую антикоагулянтную активность ПИПТ, несколько
более низкую, чем у гепарина. Тетразолсодержащие полимеры, в отличие от
гепарина, практически не влияют на активность факторов протромбинового комплекса.
Относительно низкая стоимость ПИПТ и его нетоксичность делают этот полимер
перспективным для разработки новых антикоагулянтов и тромборезистентных
материалов. В качестве определенного преимущества ПИПТ можно рассматривать
быстрое возвращение параметров системы свертывания крови к норме, так как при
клиническом применении антикоагулянтов серьезной проблемой является своевременное
прекращение их действия.
4.2. Концентрирование антигенов вирусов гепатита А
и В с помощью водорастворимых полимеров
На основе обратимо
осаждаемых полимерных систем удалось добиться многократного повышения
чувствительности методов определения антигенов вирусов гепатита А и В. Методика концентрирования заключалась в добавлении
водорастворимых полимеров к исследуемым растворам, осаждении полимеров при
понижении рН, отделении осадка и растворении его в малом количестве щелочного
буфера. Интересно, что после обработки сывороток крови нашими системами
наблюдалось не просто концентрирование, а повышение эффективного количества
антигенов, вероятно из-за разрушения их комплексов с другими биополимерами.
Наибольшую активность проявили сополимер ИПТ-ВПД (2: 1, концентрирование
антигена вируса гепатита В в 1600 раз) и ИПК ПМАК-ПВПД
(концентрирование антигена вируса гепатита А в 400 раз).

4.3. Иммуноадъювантные свойства
тетразолсодержащих полимеров
Установленная активность
тетразолсодержащих поликислот в интерполимерных реакциях позволила предложить
использование их в качестве адъювантов при получении иммунных сывороток. Полученные
данные (табл. 9) указывают на высокую активность сополимера ИПТ-ВПД при
получении антител к различным антигенам, превышающую показатели для стандарта.
Гомополимер ИПТ не проявляет данной активности, что указывает на необходимость
дополнительной стабилизации комплексов полимер-антиген за счет гидрофобных
взаимодействий с участием звеньев ВПД.
Таблица 9
Иммуноадъювантная
активность сополимера ИПТ-ВПД (2: 1)
|
Антиген |
Обратные титры антител |
|
|
Сополимер, г/л |
Полный адъювант Фрейнда |
|
|
Вируса гепатита B |
128, 0.6 |
64 |
|
Вируса комплекса Калифорнийского энцефалита Иркутск № 1796 |
160, 0.03 |
40 |
|
Вируса Батаи № 2513 |
80, 0.03 |
40 |
|
"Кодивак" |
64, 0.6 |
6 |
4.4. Сенсибилизационная
активность карбоксил- и азолсодержащих полимеров при
создании антигенных эритроцитарных диагностикумов
Диагностика многих
инфекционных заболеваний основана на определении специфических антител и
антигенов в сыворотке крови. Для этой цели широко используется реакция пассивной гемагглютинации (РПГА),
основанная на фиксации антигенов (или антител) на поверхности эритроцитов. При
контакте сенсибилизированных таким образом эритроцитов с сывороткой, содержащей
соответствующие антитела (или антигены) происходит характерная агглютинация
эритроцитов. В то же время, вещества, обычно используемые для
связывания иммуноактивных частиц с поверхностью эритроцита (глутаровый
альдегид, хлорид хрома, гидрохинон, амидол) не обеспечивают воспроизводимой
чувствительности и стабильности тест-систем при хранении. Довольно часто
наблюдаются явления спонтанной агглютинации.
Установлено, что
применение полимерных кислот (ПВТ, ПМАК, ПАК, сополимер МАК-ВТГИ) и ПВИ в качестве
связующих агентов при конструировании эритроцитарных диагностикумов позволяет повысить
чувствительность метода РПГА в 4-8 раз. При этом значительно возрастает
воспроизводимость тест-систем, они могут храниться более 3-х лет без снижения
активности.
Разработанные
иммуноадъюванты и тест-системы внедрены в диагностическую и научную практику Института эпидемиологии и
микробиологии Научного центра медицинской экологии Восточно-Сибирского научного
центра Сибирского отделения Российской академии медицинских наук и
лечебно-профилактических учреждений Иркутской области.
ВЫВОДЫ
1. При исследовании
кислотно-основных свойства поливинилазолов впервые обнаружена амфифильность
поли-N-винилазолов, которые проявляют основные свойства благодаря наличию
"пиридиновых" атомов азота, а кислотные – за счет акцепторных p-систем азольных циклов.
2. Разработан метод
моделирования кислотно-основных равновесий в растворах полиэлектролитов в
рамках теории "эффекта соседа". На основе полученной модели создан
новый подход к количественному описанию состояния интерполимерных комплексов в
растворе.
3. Исследовано
комплексообразование азол- и карбоксилсодержащих
полимеров с ионами меди (II). Показано наличие в комплексах высокой локальной
концентрации ионов меди с ярко выраженными диполь-дипольным
и обменным магнитным взаимодействиями между ними при низких степенях нейтрализации
кислотных групп. Установлено, что координационные связи с ионами Cu2+
дополнительно стабилизируют внутри- и межмолекулярные структуры, образованные
за счет водородных и ионных связей.
4. На примере сополимеров
акриловой кислоты и 1-винилимидазола показана возможность варьирования центра
координации ионов Cu2+ путем изменения кислотности среды.
5. Изучена активность
синтезированных металлополимеров в каталитических процессах на примере
окисления пространственно-затрудненных фенолов. Показано, что феноксильные
радикалы, окислительно присоединяясь к ионам Co(II), образуют промежуточные
парамагнитные соединения Co(III), в которых неспаренный электрон локализован на
углеводородном лиганде. Частичное
замещение карбоксилатных групп на ацетилацетонатные позволило синтезировать
металлополимер, обладающий хорошей растворимостью, как в воде, так и в толуоле,
что делает его перспективным для использования в качестве катализатора для
межфазных процессов.
6. Исследованы
превращения полимерных карбоновых и N-H кислот, а также их комплексов с переходными
металлами под действием рентгеновского излучения. Показано, что многообразие
линий в спектрах ЭПР углеводородных радикалов, образующихся при радиолизе
полиметакриловой кислоты, связано с конформационными проявлениями однотипных
радикалов. Обнаружены радиопротекторные свойства ионов меди (II), координационно связанных с полимерной цепью.
8. Впервые изучены
интерполимерные комплексы поли-N-винилазолов с
акриловыми и тетразолсодержащими слабыми поликислотами в широком интервале рН.
Показано, что азольные группы могут взаимодействовать как с недиссоциированными
кислотными группами, образуя водородные связи, так и с анионными группами, за счет
донорно-акцепторного взаимодействия p-систем или с образованием мостиковой связи через ион щелочного металла.
9. Исследованы
интерполимерные комплексы поли-1-винилимидазола и поли-1-винил-1,2,4-триазола с
белковыми макромолекулами. Установлено, что при рН среды менее 8 взаимодействие
осуществляется посредством водородных связей, а при более высоких значениях рН
– за счет донорно-акцепторных взаимодействий азольных циклов и карбоксилатных
анионов.
10. На
основе тетразолсодержащих полимеров разработаны новые адъюванты для получения
высокоиммунных композиций с различными антигенами. Показана возможность
разделения сложных белковых смесей с использованием обратимо-осаждаемых
полимерных систем на основе кислотных сополимеров и интерполимерных комплексов.
Разработана принципиально новая методика конструирования эритроцитарных
антигенных диагностикумов с использованием азол- и
карбоксилсодержащих полимеров в качестве связующих агентов.
Список публикаций по теме диссертации
1. Круглова В.А., Анненков В.В., Калабина А.В. Полиэлектролитные
свойства и конформация макромолекул терполимеров
2-трихлорметил-4-метилен-1,3-диоксолана, N-винилпирролидона и акриловых кислот
// Высокомол. соед. Сер.А. - 1985. - Т. 27, № 8. - С. 1649-1652.
2. Круглова В.А., Анненков В.В., Бузилова С.Р. Радикальная
сополимеризация 5-винилтетразола со стиролом // Высокомол. соед. Сер.Б. - 1986. - Т. 28, № 4. - С. 257-262.
3. Синтез и свойства азолсодержащих сополимеров винилпирролидона /
В.А. Круглова, В.В. Анненков, С.Р. Большедворская и др. // Высокомол. соед. Сер.Б. - 1986. - Т. 28, № 7. - С. 528-531.
4. Синтез сополимеров винилазолов и их
физиологическая активность / В.А. Круглова, В.В. Анненков, Л.И. Верещагин и др.
// Хим.-фарм. ж. - 1987, № 2. - С. 159-163.
5. Круглова В.А.,
Воропаева Е.Ф., Анненков В.В., Кижняев В.К. Синтез и свойства сополимеров
5-винилтетразола с акриловой кислотой // Изв. ВУЗов. Химия и хим. технол. -
1987. - Т. 30, В 12. - С. 105-109.
6. Кижняев В.Н., Круглова В.А., Анненков В.В., Верещагин Л.И.
Особенности поведения поли-С-винилтетразолов в водных средах // Высокомол.
соед. Сер. Б. - 1989. - Т. 31, № 6. - С. 420-423.
7. Синтез и исследование влияния на процесс гемокоагуляции
поли-5-изопропенилтетразола / В.А. Круглова, В.В. Анненков, Л.Т. Москвитина и
др. // Хим.-фарм. ж. - 1989, № 2. - С. 195-198.
8. Анненков В.В., Круглова В.А., Шевчук О.А. Кислотные N-H
полиэлектролиты в реакции образования интерполимерных комплексов // Высокомол.
соед. Сер. Б. - 1990. - Т. 32, № 10. - С. 723-725.
9. Круглова В.А., Анненков В.В., Аксаментов И.В. Зайцева Л.В. Влияние
свойств среды на сополимеризацию
5-изопропенилтетразола с N-винилпирролидоном // Изв. Вузов. "Химия и хим.
технол". – 1990. - Т. 33, В. 10. - С. 103-108.
10. Анненков В.В., Круглова В.А. Полиэлектролитные свойства тетразолсодержащих
сополимеров // Высокомол. соед. Cер. А. - 1991. - Т.
33, № 10. - С. 2050-2055.
11. V.V.
Annenkov, V.A. Kruglova Poly-C-vinyltetrazoles: a new type of polyacid // J. Polym.
Sci. A: Polym. Chem. – 1993.
- V. 31. - Р. 1903-1906.
12. Физиологическая активность сополимеров 5-изопропенилтетразола с
1-винилпирролидоном / В.В. Анненков, В.А. Круглова, В.Б. Казимировская и др. //
Хим.-фарм.ж. – 1995, № 1. - С. 38-41.
13. Анненков В.В., Круглова В.А., Мазяр Н.Л. Учет "эффекта
соседа" в кислотно-основных равновесиях полиэлектролитов // Высокомол.
соед. Сер. Б. - 1996. - Т. 38, № 1. - С. 133-134.
14. Annenkov
V.V., Kruglova V.A., Mazyar N.L. Complexes of poly-5 -vinyltetrazoles with weak
polybases // J. Polym. Sci. A: Polym. Chem. – 1996. – V. 34. - Р. 597-602.
15. Лещук С.И., Анненков В.В., Круглова В.А., Скопинцева И.А.
Концентрирование антигенов вирусов гепатита А и В с помощью водорастворимых полимеров // Вопросы вирусологии.
– 1996. - Т. 41, № 3. - С. 135-138.
16. Annenkov
V.V., Kruglova V.A. Polyvinyltetrazoles // in Polymeric Materials Encyclopedia
/ed. J.P.Salamone. –
17. Даниловцева Е.Н., Анненков В.В., Домнина Е.С., Михалева А.И.
Сополимеризация 1-винил-4,5,6,7-тетрагидроиндола со стиролом // Высокомол.
соед. Сер. Б. - 1996. - Т. 38, № 11. - С. 1925-1927.
18. Взаимодействие поли-5-винилтетразола с ионами меди в водном
растворе / В.А. Круглова, В.В. Анненков, В.В. Сараев и др. // Высокомол. соед.
Сер. Б. - 1997. - Т. 39, № 7. - С. 1257-1259.
19. Annenkov
V.V., Kruglova V.A., Mazyar N.L. Analysis of the potentiometric titration
curves within the framework of the theory of the "neighbor effect" //
J. Polym. Sci. B: Polym. Phys. – 1998. ‑ V. 36. ‑ Р. 931-936.
20. Анненков В.В., Круглова В.А., Мазяр Н.Л. Применение теории
"эффекта соседа" в потенциометрическом титровании полиэлектролитов //
Высокомол. Соед. Сер. А. – 1998. ‑ Т. 40, № 3. ‑ С. 466-471.
21. Анненков В.В., Даниловцева Е.Н., Михалева А.И. Синтез и
свойства сополимеров 1-винил-4,5,6,7-тетрагидроиндола с малеиновой кислотой //
Высокомол. Соед. Сер. Б. – 1998. ‑ Т 40, № 2. ‑ С. 366-368.
22. Сараев В.В., Алсарсур И.А., Анненков В.В., Щипунов Д.В. Изучение
методом ЭПР кластерообразования в системе полиметакриловая кислота – ионы меди
(II) // Коорд. Химия. – 1999. - Т. 25, № 12. - С. 919-922.
23. Взаимодействие сополимеров 1-винил-4,5,6,7-тетрагидроиндола и
малеиновой кислоты с ионами переходных металлов в растворе / В.В. Анненков,
И. Алсарсур, Е.Н. Даниловцева и др. // Высокомол. Cоед.
Сер. А. – 1999. - Т. 41, № 9. - С. 1404-1408.
24. Исследование взаимодействия полиакриловой кислоты с
поли-1-винилазолами / Н.Л. Мазяр, В.В. Анненков, В.А. Круглова и др. //
Высокомол. соед. Сер. А. – 1999. - Т.41, № 2. - С. 357-362
25. Взаимодействие бычьего сывороточного альбумина с поли-N-винилазолами / В.В. Анненков, Н.Л. Мазяр, В.А. Круглова и
др.// Высокомол. соед. Сер. А. – 2000. - Т. 42, №11. – C. 1804-1810.
26. Кислотно-основные свойства поли-1-винилазолов в водном растворе /
Н.Л. Мазяр, В.В. Анненков, В.А. Круглова и др. // Изв. РАН Сер. хим. – 2000, № 12. – C.
2047-2052.
27. Annenkov V.V. Mazyar N.L., Kruglova V.A.,
Ananiev S.M. Equilibria
in Solutions of Complexes of Poly(acrylic acids) and Poly(N-vinylazoles) // J.
Mol. Liq. – 2001. – V. 91. – P. 109-114.
28. Анненков В.В., Даниловцева Е.Н., Луненок О.В., Алсарсур И.А., Сараев В.В., Взаимодействие сополимера акриловой кислоты и 1-винилимидазола с ионами меди (II) в водной среде // Изв. РАН Сер. хим. ‑ 2001, № 8. – C. 1317-1323.
29. Анненков В.В., Лебедева О.В., Даниловцева Е.Н., Михалева А.И. Синтез и полиэлектролитные свойства карбоксилсодержащих сополимеров 1-винил-4,5,6,7-тетрагидроиндола // Высокомол. соед. Сер. Б. ‑ 2001. ‑ Т. 43, № 9. ‑ С. 1560-1564
30. Анненков
В.В., Мазяр Н.Л., Круглова В.А. Интерполимерные комплексы
поли-5-винилтетразола и поли-1-винилазолов // Высокомол. соед. Сер. А. ‑
2001. ‑ Т. 43, № 8. ‑ С. 1308-1314.
31. Исследование сорбционной и
тромболизирующей активности полимеров на основе винилтри-
и тетразолов / В.А. Круглова, В.В. Анненков, О.В. Землянушнова и др. // Тез.
докл. VII Всесоюзн. симпоз. "Синтетические полимеры медицинского назначения".
– Минск, 1985. - С. 88.
32. Анненков В.В.,
Круглова В.А., Бузилова С.П. Синтез и исследование кислотных свойств сополимеров
5-изопропенилтетразола со стиролом // Тез. докл. III Всесоюзн.
конф. "Водорастворимые полимеры и их применение". - Иркутск, 1987. -
С. 100.
33. Круглова
В.А.,Кижняев В.Н., Анненков В.В. Поведение полимеров 5-винил и
5-изопропенилтетразолов в водных средах // Тез. докл. III
Всесоюзн. конф. "Водорастворимые полимеры и их применение". -
Иркутск, 1987. - С. 99.
34. Анненков В.В, Круглова В.А., Верещагин Л.И. Интерполимерные
комплексы на основе поливинилазолов // Тез. докл. 2 Всесоюзн. конф. "Интерполимерные комплексы".
- Рига, 1989. - С. 19.
35. Анненков В.В., Круглова В.А., Аксаментов И.В. Влияние рН и
полярности среды на сополимеризацию 5-изопропенилтетразола и N-
винилпирролидона // Тез докл. Всесоюзн. конф. "Радикальная полимерзация".
- Горький, 1989. - С. 24-25.
36. Иммуностимулирующие и иммуноадъювантные свойства сополимеров
5-изопропенилтетразола и 1-винилпирролидона / В.В. Анненков, Н.М. Бойко,
С.И.Лещук и др. / Тез. докл. IХ Всесоюзн. симп. по целенаправленному изысканию
лекарственных веществ. - Рига, 1991. - С. 50.
37. Анненков В.В., Круглова В.А., Кижняев В.Н. Анионные и катионные
тетразолсодержащие полимеры // Тез. докл
11 Всесоюзн. конф. "Свойства и применение водорастворимых полимеров".
- Ярославль, 1991. - С. 46.
38. Анненков В.В., Круглова В.А., Шевчук О.А. Поли-5-винил(изопропенил)тетразол в реакциях с некоторыми
водорастворимыми полимерами // Тез. докл. IV Всесоюзн. конф. по водорастворимым
полимерам. - Иркутск, 1991. - С. 61.
39. Анненков В.В., Круглова В.А., Игошин В.А. Гидродинамические свойства и охлаждающая способность
закалочных сред на основе полимера ПК-2 // Тез. докл. 11
Всесоюзн. конф. "Свойства и применение водорастворимых полимеров". -
Ярославль, 1991. - С. 137.
40. Получение высокоактивной иммунной сыворотки с помощью полимерного
иммуноадъюванта / С.И. Лещук, В.В. Анненков, В.А. Круглова. // Мат. научн.-практ. конф., посв. 60-летию Исфаринской сан.-эпид.
службы. - Исфара, 1992. - С. 84-86.
41. Анненков В.В., Круглова В.А., Лещук С.И. Обнаружение возбудителей
инфекции в окружающей среде. Новый подход к концентрированию антигенов
патогенных вирусов // Матер. международ.
конф." Экологически чистые технологичиские процессы в решении проблем
охраны окружающей среды". - Иркутск, 1996, Т. 1. - C. 84.
42. Annenkov
V.V., Mazyar N.L., Kruglova V.A., Ananiev S.M. Equilibria in solutions of
complexes of poly(acrylic acids) and poly(N-vinylazoles) // Abstracts: VII
International conference "The problems of solvation and complex formation
in sоlution".
-
43. Сараев В.В., Алсарсур И.А., Анненков В.В. Исследование методом ЭПР
взаимодействия феноксильных радикалов с бис-ацетилацетонат кобальтом (II) //
Мат. Всерос. заочной конф."Катализ в биотехнологии,
химии и химических технологиях. – Тверь, 1999. - С. 32-34.
44. Анненков В.В., Круглова В.А., Мазяр Н.Л., Ичева И.А.
Взаимодействие бычьего сывороточного альбумина с поли-N-винилазолами // Тез. докл. II Международ. симпоз.
"Физико-химические основы функционирования белков и их комплексов". –
Воронеж, 1998. - С. 55.
45. Применение обратимо осаждаемых полимерных систем для
концентрирования антигенов патогенных вирусов и ионов тяжелых металлов / В.В
Анненков, В.А. Круглова, С.И Лещук и др. // Тез.докл.
III Всерос. конф. по анализу объектов окружающей среды
"Экоаналитика-98". – Краснодар, 1998. - С. 97-98.
46. Сараев В.В., Алсарсур И.А., Анненков В.В. Исследование методом ЭПР
взаимодействия феноксильных радикалов с бис-ацетилацетонат кобальтом (II) // Материалы Всерос. заочной
конф. "Перспективы развития Волжского региона". – Тверь. – 1999. - С.
213-215.
47. Взаимодействие ионов меди (II) с азолсодержащими полиэлектролитами
в водных растворах / В.В. Анненков, И.А. Алсарсур., В.А. Круглова и др. // Тез. докл. II Всероссийск. Каргинского
симпоз. (с межд. участием)
"Химия и физика полимеров в начале ХХI
века". – Москва, 2000. - С. С1-21.
48. Анненков В.В., Мазяр Н.Л., Круглова В.А. Поли-5-винилтетразол в
реакциях интерполимерного комплексообразования // Там-же. - С. С1-22.
49. Лебедева О.В., Анненков В.В., Даниловцева Е.Н., Михалева А.И. Новые
водорастворимые сополимеры на основе 1-винил-4,5,6,7-тетрагидроиндола. Синтез и
свойства. // Там-же. - С. С1-93.
50. Кислотно-основные свойства поли-1-винилазолов в разбавленных
водных растворах / Н.Л. Мазяр, В.В. Анненков, В.А. Круглова и др.// Там-же. -
С. С3-11.
51. В.В. Анненков, В.В. Сараев, И.А. Алсарсур, Е.Н. Даниловцева.
Радиолиз полимерных кислот винильного и винилиденового ряда. Влияние на
надмолекулярную структуру // Там-же. - С. С1-23.
52. А.с. 1578143 (СССР) Сополимер
5-изопропенилтетразола и N- винилпирролидона, обладающий свойствами
иммуноадъюванта поверхностного антигена вирусного гепатита В / В.В. Анненков,
С.И. Лещук, В.А. Круглова и др. // Опубл. 15.07.90, Бюл. № 26.
53. Патент РФ № 2068420 Этаноламмониевая соль поли-5-винилтетразола в качестве
пленкообразующего компонента для косметических препаратов / Л.И. Верещагин,
В.В. Анненков, В.Н. Платонова // Опубл. 27.10.96, Бюл. № 30.
54. Патент РФ № 2111013. Способ получения антител к арбовирусам
комплекса Калифорнийского энцефалита и Батаи / В.В. Анненков, В.А. Круглова,
А.З. Феоктистов и др. // Опубл. 20.05.98, Бюл. № 14.
55. Патент РФ № 2129014. Способ получения антител к коринебактериям
дифтерии / В.В. Анненков,
С.И. Лещук, В.А. Круглова, Е.А. Шмелева, С.М Попкова. // Опубл. 20.04.99, Бюл.№ 11.
56. I.P. Kovalev, V.V. Annenkov, S.A. Carlson,
B.A. Trofimov Electroactive polymers
of high sulfur content for use in electrochemical cells // International
Application N WO067340A1, Published under the Patent Cooperation Treaty (PCT),
Publ. date: 09.11.00.
57. Лещук С.И., Анненков В.В. Новые иммуноадъюванты и тест-системы на основе водорастворимых полимеров // Метод. письмо 3.1.001-01. – Иркутск: Центр Госсанэпиднадзора в Иркутской области, 2001. – 7 с.
![]()