РОССИЙСКАЯ АКАДЕМИЯ НАУК
ИНСТИТУТ
ЭЛЕМЕНТООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ИМЕНИ А.Н.
НЕСМЕЯНОВА
На правах рукописи
ЛЮБИМОВ СЕРГЕЙ ЕВГЕНЬЕВИЧ
СИНТЕЗ НОВЫХ
МОНОДЕНТАТНЫХ ФОСФИТНЫХ
И АМИДОФОСФИТНЫХ ЛИГАНДОВ И ИХ
ИСПОЛЬЗОВАНИЕ
В АСИММЕТРИЧЕСКОМ Pd-КАТАЛИЗИРУЕМОМ
АЛЛИЛЬНОМ ЗАМЕЩЕНИИ
И Rh-КАТАЛИЗИРУЕМОМ
ГИДРИРОВАНИИ
02.00.08 –
Химия элементоорганических соединений
02.00.03 –
Органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата
химических наук
Москва-2006
Работа выполнена в лаборатории Стереохимии
сорбционных процессов
Института элементоорганических соединений имени А.Н.
Несмеянова РАН
Научные
руководители:
доктор химических наук,
профессор
Даванков Вадим Александрович
доктор химических наук,
профессор
Гаврилов Константин Николаевич
Официальные
оппоненты:
доктор химических наук,
профессор
Виноградов Максим
Гаврилович
кандидат химических наук,
старший научный сотрудник Лойм Николай Михайлович
Ведущая организация: Московский государственный
университет
имени М.В. Ломоносова
Защита диссертации состоится "14" ноября
2006 г. в 10 часов на заседании диссертационного совета К
002.250.01 по присуждению ученой степени кандидата химических наук в Институте
элементоорганических соединений имени А.Н. Несмеянова РАН по адресу: 119991,
ГСП-1, Москва, ул. Вавилова, д. 28
С диссертацией можно ознакомиться в библиотеке ИНЭОС РАН.
Автореферат разослан " 9 " октября 2006 года.
Ученый секретарь
диссертационного совета К
002.250.01,
кандидат химических наук
В.А. Ольшевская
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы.
Асимметрический катализ представляет собой один из удобных подходов к синтезу
оптически активных соединений, в том числе применяемых в качестве медицинских
препаратов, биодобавок и гербицидов. Среди асимметрических реакций,
катализируемых комплексами переходных металлов, можно особо выделить аллильное
замещение, привлекательное разнообразием формируемых типов связей (C-C, C-O, C-N, C-S), и
гидрирование, отличающееся использованием молекулярного водорода как наиболее
дешевого восстановителя, и, как следствие, широкими перспективами промышленного
использования. Несмотря на существовавшее более 30 лет положение, что
бидентатные лиганды необходимы для достижения высоких значений
энантиоселективности, в последнее время все большее внимание стало уделяться монодентатным лигандам, что
связано с простотой их синтеза и высокой эффективностью в асимметрических
процессах. Несомненными лидерами среди монодентатных лигандов по синтетической
доступности являются фосфиты и амидофосфиты, кроме
того, применение этих лигандов позволило достигнуть количественных значений
энантиомерного избытка (>99% ее) в Rh-катализируемом гидрировании прохиральных алкенов, Cu–катализируемом сопряженном
присоединении, Ir–катализируемом аллилировании, Pd–катализируемом гидросилилировании-окислении,
Ni-катализируемом гидровинилировании. Однако существует всего несколько
примеров использования монодентатных лигандов фосфитного типа в Pd-катализируемом аллильном
замещении.
Таким образом, представляется актуальным осуществление синтеза новых
доступных монодентатных фосфитных и амидофосфитных
лигандов, а также изучение их каталитического потенциала в целом ряде
асимметрических реакций, таких как Pd-катализируемое аллильное алкилирование,
аминирование, сульфонилирование, а также Rh-катализируемое
гидрирование.
Цель работы. Синтез
новых эффективных хиральных монодентатных фосфитных и амидофосфитных
лигандов для реакций Pd-катализируемого
аллильного замещения и Rh-катализируемого гидрирования.
Научная новизна и практическая ценность
работы
II. Проведено
исследование координационного поведения новых лигандов по отношению к таким предкатализаторам асимметрических реакций как [Pd(allyl)Cl]2,
[Rh(COD)2]+BF4-.
III. Новые
монодентатные лиганды были успешно протестированы в Pd-катализируемом аллильном
алкилировании 1,3-дифенилпропен-2-ил ацетата диметилмалонатом (до 99% ее), в сульфонилировании пара-толуолсульфинатом натрия (до 99% ее), в аминировании
пирролидином и пропиламином (до 99% ее), в амидировании диформиламидом
натрия (до 86% ее), а также в реакции дерацемизации 1,3-дифенилпроп-2-енил
этилкарбоната (до 96% ее). Новые монодентатные
лиганды оказались также эффективным в реакции Rh-катализируемого
гидрирования прохиральных метиловых эфиров
ненасыщенных кислот (до 99% ее).
IV.
Впервые предложено использовать ионные жидкости как среду для проведения
асимметрических реакций с привлечением металлокомплексных
катализаторов на основе монодентатных фосфитов и амидофосфитов.
В результате удалось достигнуть до 84% ее в реакции аминирования
1,3-дифенилпропен-2-ил ацетата ди-н-пропиламином, причем уровень асимметрической индукции
сохраняется после трехкратной рециклизации
катализатора.
Состав и строение полученных соединений подтверждены широким набором
физико-химических методов исследования: ЯМР 1Н, 13С, 31Р,
19F,
спектроскопией, ИКС, масс- спектрометрией методами электронного удара и электрораспыления, а также элементным анализом.
Энантиомерный избыток продуктов реакций определен методом ВЭЖХ-хроматографии
на хиральных стационарных фазах.
Апробация работы. Результаты
работы докладывались на 4 международных конференциях: 1). International conference dedicated to 50th
anniversary of A.N. Nesmeyanov Institute of Organoelement Compounds, “Modern Trends in organoelement and polymer chemistry,
Публикации.
Основное
содержание работы изложено в 7 статьях и 4 тезисах докладов на конференциях.
Структура и
объем работы. Диссертация состоит из введения, литературного обзора, обсуждения
результатов, экспериментальной части, выводов и списка литературы из 176
наименований. Работа изложена на 122 страницах.
Основное
содержание работы.
I. 1. Лиганды с ахиральными экзоциклическими заместителями.
Несмотря на высокую эффективность монодентатных
фосфитов и амидофосфитов на основе БИНОЛ, содержащих
дополнительные стереоцентры, лиганды с исключительно
аксиальной хиральностью более привлекательны из-за простоты их синтеза и
доступности исходных компонентов. Одностадийным
фосфорилированием ахиральных спиртов и аминов нами была синтезирована серия
новых монодентатных фосфитов и амидофосфитов (схема
1).
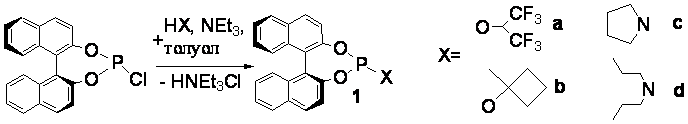
Схема 1.
Фосфиты 1 a,b и амидофосфиты 1 c,d были протестированы в реакции Pd-катализируемого аллильного
алкилирования 1,3-дифенилпроп-2-енил ацетата диметилмалонатом в среде ТГФ
(схема 2).
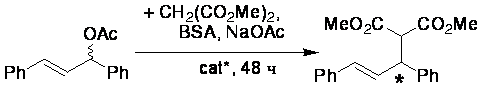
Схема 2.
|
опыт |
катализатор |
соотношение
Pd/L |
конверсия,
% |
ее,
% |
|
1 |
[Pd(allyl)Cl]2/1a |
1/1 |
7 |
32
(S) |
|
2 |
[Pd(allyl)Cl]2/1a |
2/1 |
6 |
33 (S) |
|
3 |
[Pd(allyl)Cl]2/1b |
1/1 |
12 |
9 (R) |
|
4 |
[Pd(allyl)Cl]2/1b |
2/1 |
15 |
8 (R) |
|
5 |
[Pd(allyl)Cl]2/1c |
1/1 |
20 |
60 (R) |
|
6 |
[Pd(allyl)Cl]2/1c |
2/1 |
18 |
54 (R) |
|
7 |
[Pd(allyl)Cl]2/1d |
1/1 |
75 |
86 (R) |
|
8 |
[Pd(allyl)Cl]2/1d |
2/1 |
68 |
83 (R) |
Таблица 1.
В результате было установлено, что фосфитные лиганды 1 a,b,
независимо от соотношения L/Pd, дают низкую конверсию (до
15%) и оптические выходы (не более 33% ее). Амидофосфиты
1 c,d оказались более эффективными (до 86% ее и 75% конверсии). В целях внесения
возможности оптимизации полученных результатов для лигандов 1а и 1d были синтезированы катионные
тетрафторборатные комплексы Pd(II) (2a,d, схема
3).
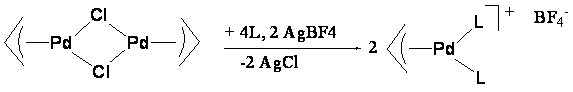
Схема 3.
Применение их в
качестве катализаторов аллильного алкилирования 1,3-дифенилпроп-2-енил ацетата
диметилмалонатом позволило увеличить химический и оптический выходы продукта
реакции в случае 2d (L =
1d) (90% ее, 99% конверсии). Однако комплекс 2a с
акцепторным фосфитным лигандом 1a и в данном случае оказался не
эффективным (8% конверсии).
Лиганды 1а-d, а также комплекс 2d были протестированы в реакции сульфонилирования
1,3-дифенилпроп-2-енил ацетата пара-толуолсульфинатом натрия (схема 4, таблица 2).
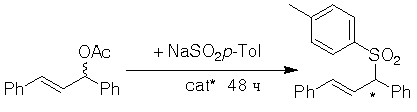
Схема 4.
|
опыт |
катализатор |
соотношение Pd/L |
конверсия,
% |
ее,
% |
|
1 |
[Pd(allyl)Cl]2/1a |
1/1 |
0 |
0 |
|
2 |
[Pd(allyl)Cl]2/1a |
2/1 |
0 |
0 |
|
3 |
[Pd(allyl)Cl]2/1b |
1/1 |
21 |
72 (S) |
|
4 |
[Pd(allyl)Cl]2/1b |
2/1 |
21 |
70 (S) |
|
5 |
[Pd(allyl)Cl]2/1c |
1/1 |
35 |
46 (R) |
|
6 |
[Pd(allyl)Cl]2/1c |
2/1 |
0 |
0 |
|
7 |
[Pd(allyl)Cl]2/1d |
1/1 |
70 |
75 (R) |
|
8 |
[Pd(allyl)Cl]2/1d |
2/1 |
18 |
71 (R) |
|
9 |
2d |
2/1 |
67 |
72
(S) |
Таблица 2.
И в данной реакции наиболее эффективным оказался амидофосфит
1d (75% ее)
при соотношении L/Pd =1/1.
Нами также было исследовано применение палладиевых комплексов
монодентатных фосфитных и амидофосфитных производных
БИНОЛ в качестве катализаторов аллильного аминирования 1,3-дифенилпроп-2-енил
ацетата ди-н-пропиламином
(схема 5).
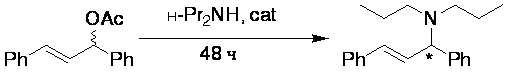
Схема 5.
Помимо обычных
органических растворителей в качестве реакционной среды была также использована
ионная жидкость (1-бутил-2,3-диметилимидазолий тетрафторборат = [bdmim]BF4). Хотя
Pd-катализируемый синтез близкого по структуре продукта, рацемического 1-((E)-1,3-дифенилаллил)пирролидина из 1,3-дифенилпроп-2-енил ацетата, протекающий
в ИЖ, был описан еще в 1999 году, до настоящего момента не был известен
асимметрический вариант этой реакции в среде ИЖ. Также отсутствовали и примеры
использования катализаторов на основе хиральных фосфитов в процессах с участием
ИЖ в качестве растворителя. Для проведения каталитических экспериментов в среде
ИЖ нами были выбраны как готовые катионные комплексы Pd (2a,d), так и нейтральные (3a,d),
полученные согласно схеме 6 на основе акцепторного фосфитного лиганда 1а и амидофосфитного
1d.
Схема 6.
|
опыт |
комплекс |
среда |
цикл |
конверсия, % |
ее, %* |
|
1 |
3a |
ТГФ |
- |
12 |
61 (-) |
|
2 |
3a |
[bdmim]BF4 |
1 |
59 |
11 (-) |
|
3 |
3d |
ТГФ |
1 |
30 |
51 (-) |
|
4 |
3d |
[bdmim]BF4 |
1 |
96 |
58 (-) |
|
5 |
3d |
[bdmim]BF4 |
2 |
65 |
58 (-) |
|
6 |
3d |
[bdmim]BF4 |
3 |
30 |
58 (-) |
|
7 |
2a |
ТГФ |
1 |
28 |
50 (-) |
|
8 |
2a |
[bdmim]BF4 |
1 |
56 |
7 (+) |
|
9 |
2d |
ТГФ |
1 |
48 |
56 (-) |
|
10 |
2d |
[bdmim]BF4 |
1 |
97 |
50 (-) |
|
11 |
2d |
[bdmim]BF4 |
2 |
40 |
51 (-) |
|
12 |
2d |
[bdmim]BF4 |
3 |
10 |
51 (-) |
* в скобках указан знак удельного вращения продукта
реакции.
Таблица 3.
При проведении реакции в ТГФ металлокомплексы 2a,d и
3a,d продемонстрировали
близкую энантиосективность (50-60% ee). При использовании ИЖ палладиевые комплексы на основе амидофосфитного лиганда 1d обеспечивают
примерно такую же энантиоселективность, как и в ТГФ,
причем, как правило, при существенно большей конверсии (в первом цикле).
Необходимо отметить, что ИЖ позволяет использовать каталитическую систему
многократно. При этом уровень асимметрической индукции сохраняется для трех
последовательных циклов, хотя конверсия существенно снижается, что связано либо
с частичным вымыванием комплекса из ИЖ в ходе экстракции продукта
каталитической реакции, либо с окислением катализатора.
При тестировании лигандов 1a,d в Rh-катализируемом гидрировании диметилитаконата
(схема 7) нами были отмечены те же тенденции, что и в Pd-катализируемом аллильном замещении. Амидофосфит 1d предоставляет большую конверсию (48%) и
энантиоселективность (76% ее (S)) по сравнению с
акцепторным фосфитом 1а (26%
конверсии, 56% ее (S)).
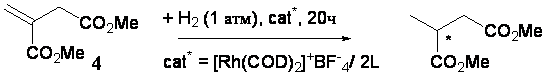
Схема 7.
I. 2. Фосфиты с ахиральными ионными экзоциклическими
заместителями.
Синтез и
каталитическое использование ахиральных ионных фосфитов хорошо известны, в то
время как тестирование ионных хиральных фосфитов до настоящей времени не
проводилось, а это представляется достаточно интересным, поскольку, оптически
активные катионные фосфины и фосфиниты хорошо зарекомендовали себя в
асимметрическом катализе. Исходя из этого, были получены катионные
фосфиты 5,6 (схема 8), содержащие
как фрагмент кватернизованного аминоспирта, так и ионной жидкости.
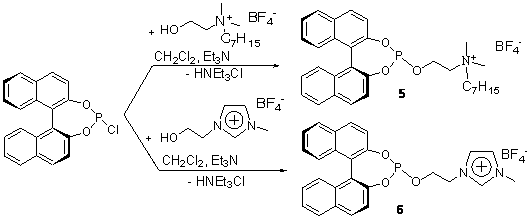
Схема 8.
В
отличие от традиционного синтетического подхода к получению ионных фосфитов,
заключающегося в кватернизации P,N-бидентатных
соединений, новые лиганды были синтезированы прямым фосфорилированием
соответствующих гидроксилсодержащих ионных субстратов. Катионные фосфиты
5,6 проявили себя как типичные
монодентатные лиганды по отношению к [Rh(COD)2]BF4 и [Pd(allyl)Cl]2 (схема
9).
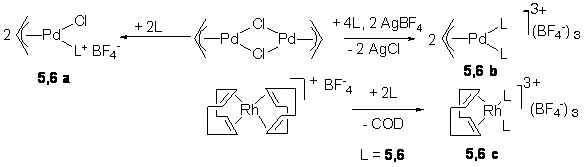
Схема 9.
Фосфиты 5,6 и родиевые
комплексы 5,6c на их
основе были первоначально протестированы в асимметрическом гидрировании прохиральных метиловых эфиров ненасыщенных кислот (схема 10,
таблица 4): диметилитаконата (4) и (Z)-метил-2-ацетамидо-3-фенилакрилата (7).
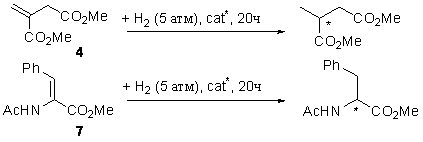
Схема 10.
|
опыт |
субстрат |
катализатор |
растворитель |
конверсия,
% |
еe,
% |
|
1 |
4 |
[Rh(COD)2]BF4/5 |
CH2Cl2 |
80 |
89 (S) |
|
2 |
4 |
5c |
CH2Cl2 |
98 |
92 (S) |
|
3 |
4 |
[Rh(COD)2]BF4/6 |
CH2Cl2 |
100 |
94 (S) |
|
4 |
4 |
6c |
CH2Cl2 |
100 |
94 (S) |
|
5 |
7 |
[Rh(COD)2]BF4/5 |
CH2Cl2 |
99 |
97 (R) |
|
6 |
7 |
5c |
CH2Cl2 |
100 |
99 (R) |
|
7 |
7 |
[Rh(COD)2]BF4/6 |
CH2Cl2 |
100 |
96 (R) |
Таблица 4.
Для всех
каталитических систем наблюдается высокая энантиоселективность (до 99% ее) и, в
большинстве случаев, количественная конверсия.
Ионные лиганды 5,6 и
палладиевый комплекс 6b были использованы в реакции Pd-катализируемого аллильного
сульфонилирования 1,3-дифенилпроп-2-енил ацетата пара-толуолсульфинатом натрия
(схема 4, таблица 5), при этом был достигнут 99% оптический выход. Лиганд 5 с алкилимидазолиевой
группой, тем не менее, оказался нерезультативным.
|
опыт |
катализатор |
L/Pd Pd/L |
растворитель |
конверсия,
% |
ее,
% |
|
1 |
[Pd(allyl)Cl]2/5 |
1/1 |
ТГФ |
0 |
0 |
|
2 |
[Pd(allyl)Cl]2/5 |
2/1 |
ТГФ |
0 |
0 |
|
3 |
[Pd(allyl)Cl]2/6 |
1/1 |
ТГФ |
31 |
83 (R) |
|
4 |
[Pd(allyl)Cl]2/6 |
2/1 |
ТГФ |
31 |
81 (R) |
|
5 |
6b |
2/1 |
ТГФ |
73 |
99 (R) |
Таблица 5.
I.3. Монодентатные лиганды на основе БИНОЛ с дополнительными элементами
хиральности.
Одностадийным фосфорилированием монометилированого
(S)-БИНОЛ (8), были
получены (R,S) и (S,S) диастереомерные
лиганды 9 и 10 (схема 11).

Схема 11.
На основе фосфитов 9,10 были
синтезированы катионные тетрафторборатные комплексы Pd(II) 9а и 10a (схема 3) для
дальнейшего использования в реакциях аллильного замещения. Применение лигандов
в аллильном алкилировании 1,3-дифенилпроп-2-енил ацетата диметилмалонатом
(схема 2, таблица 6) показало, что в случае соотношения L/Pd = 1/1 S,S-диастереомер
(10) обеспечивает большую
энантиоселективность (67% ее) по сравнению с R,S-изомером (9). Та же тенденция наблюдается и при
соотношении L/Pd = 2/1 (61 и 30% ее
соответственно). Использование тетрафторборатных комплексов 9,10 a привело к
одинаковому энантиомерному избытку продукта реакции
(56% ее), но при различной конверсии (71 и 59%). Тестирование более
эффективного из этих комплексов (9a) в ТГФ позволило увеличить энантиоселективность до 72% ее,
однако, с частичной потерей активности катализатора.
|
опыт |
катализатор |
L/Pd |
растворитель |
конверсия,
% |
ee,
% |
|
1 |
[Pd(allyl)Cl]2/10 |
1/1 |
CH2Cl2 |
53 |
67 (S) |
|
2 |
[Pd(allyl)Cl]2/10 |
2/1 |
CH2Cl2 |
32 |
61 (S) |
|
3 |
10a |
2/1 |
CH2Cl2 |
59 |
56 (S) |
|
4 |
[Pd(allyl)Cl]2/9 |
1/1 |
CH2Cl2 |
40 |
52 (S) |
|
5 |
[Pd(allyl)Cl]2/9 |
2/1 |
CH2Cl2 |
60 |
30 (S) |
|
6 |
9a |
2/1 |
CH2Cl2 |
71 |
56 (S) |
|
7 |
9a |
2/1 |
ТГФ |
38 |
72 (S) |
Таблица 6.
В реакции
аминирования 1,3-дифенилпроп-2-енил ацетата ди-н-пропиламином (схема 5, таблица
7) при использовании катализаторов, приготовленных in situ (опыты 1,2,4,5), напротив,
R,S- диастереомер (9) более
эффективен (до 74% ее), тогда как S,S-изомер (10) привел к практически рацемическому продукту.
|
опыт |
катализатор |
L/Pd |
растворитель |
конверсия,
% |
ее,
% |
|
1 |
[Pd(allyl)Cl]2/(10) |
1/1 |
CH2Cl2 |
26 |
4 (-) |
|
2 |
[Pd(allyl)Cl]2/(10) |
2/1 |
CH2Cl2 |
21 |
2 (-) |
|
3 |
10a |
2/1 |
CH2Cl2 |
100 |
44
(-) |
|
4 |
[Pd(allyl)Cl]2/(9) |
1/1 |
CH2Cl2 |
40 |
50
(+) |
|
5 |
[Pd(allyl)Cl]2/(9) |
2/1 |
CH2Cl2 |
39 |
74 (+) |
|
6 |
9а |
2/1 |
CH2Cl2 |
100 |
6 (+) |
Таблица 7.
В целях оптимизации синтеза и результативности подобных соединений нами
был предложен новый подход к получению монодентатных фосфитов (13, 14а, 14b) на
основе только БИНОЛ 11 и его
аналогов (Н8-БИНОЛ (12a) и Br2-H8-БИНОЛ (12b)), путем их прямого фосфорилирования при мольном соотношении бинафтолов к трихлориду фосфора
2/1 (схема 12).
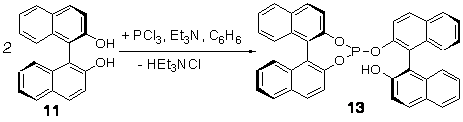
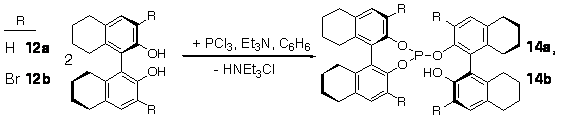
Схема 12.
Отметим, что
такой способ получения именно одностадиен, так как не
требует первоначального синтеза такого интермедиата,
как хлорфосфит. Узкая полоса колебаний n(OH) для соединений 13, 14a,b в
хлороформе, а также отсутствие смещения Dn(OH) в широких пределах концентраций в ССl4 говорят о
наличии внутримолекулярной водородной связи.
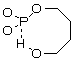
Наличие гидроксильной группы в данных структурах позволяет осуществлять
достаточно простые модификации, в том числе для увеличения стерического
фактора лиганда. Так, для 13 при
комнатной температуре, в одну стадию, было получено триметилсилильное
производное 15 при взаимодействии с N,O-бис(триметилсилил)ацетамидом (BSA, схема 13).
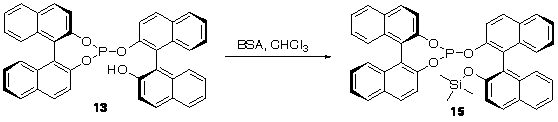
Схема 13.
Нами также был синтезирован лиганд 16
на основе (S,S)-гидробензоина (схема 14).

Схема 14.
В данном случае
наблюдается исключительно фосфорановая структура, в
отличие от лигандов 13-14a,b, что подтверждено как ЯМР 31Р,
так и ИК спектроскопией.
Для фосфитов 13, 14а были
синтезированы катионные палладиевые комплексы 17 (L= 13) и 17а (L= 14a) согласно схеме 3 для
использования в процессах аллильного замещения. В реакции аллильного
алкилирования 1,3-дифенилпроп-2-енил ацетата (схема 2) арилфосфит
15, обладающий объемной триметилсилильной группой, как и ожидалось, обеспечил
великолепный энантиомерный избыток 97% ее (таблица 8, опыт 10).
|
опыт |
катализатор |
L*/Pd |
растворитель |
конверсия,% |
ee ,% |
|
1 |
[Pd(allyl)Cl]2/13 |
1/1 |
CH2Cl2 |
89 |
95 (R) |
|
2 |
[Pd(allyl)Cl]2/13 |
2/1 |
CH2Cl2 |
93 |
78 (R) |
|
3 |
17 |
2/1 |
CH2Cl2 |
99 |
86 (R) |
|
4 |
[Pd(allyl)Cl]2/14a |
1/1 |
CH2Cl2 |
68 |
71 (R) |
|
5 |
[Pd(allyl)Cl]2/14a |
2/1 |
CH2Cl2 |
69 |
52 (R) |
|
6 |
17a |
2/1 |
ТГФ |
50 |
90 (R) |
|
7 |
17a |
2/1 |
CH2Cl2 |
85 |
81 (R) |
|
8 |
[Pd(allyl)Cl]2/14b |
1/1 |
CH2Cl2 |
5 |
48 (R) |
|
9 |
[Pd(allyl)Cl]2/14b |
2/1 |
CH2Cl2 |
14 |
63 (R) |
|
10 |
[Pd(allyl)Cl]2/15 |
1/1 |
CH2Cl2 |
50 |
97 (R) |
|
11 |
[Pd(allyl)Cl]2/15 |
2/1 |
CH2Cl2 |
30 |
65 (R) |
|
12 |
[Pd(allyl)Cl]2/16 |
1/1 |
CH2Cl2 |
76 |
43 (S) |
|
13 |
[Pd(allyl)Cl]2/16 |
2/1 |
CH2Cl2 |
50 |
54 (S) |
Таблица 8.
Лиганд 13 обеспечил близкую
энантиоселективность (до 95% ee), но с более высокой
конверсией по сравнению с его кремнийсодержащим аналогом 15 (таблица 8, опыты 1 и 10). Несмотря на то, что при помощи фосфорана 16 удалось
получить невысокий энантиомерный избыток в этой реакции (до 54% ee), это все равно лучший результат, достигнутый для Pd-катализируемого аллильного
замещения с использованием гидроспирофосфорановых
структур.
В аллильном аминировании 1,3-дифенилпроп-2-енил ацетата
пирролидином (схема 15), лиганды 13 и 14a оказались менее результативными, по сравнению аллильным алкилированием (до 61%
и 51% ee,
соответственно), причем объемные арилфосфиты 14b и 15 и фосфоран 16
показали низкую энантиоселективность (до 45% ее).
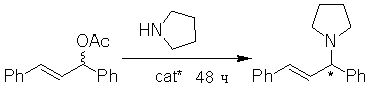
Схема 15.
Нейтральный 18 (получен согласно схеме 6) и
катионный 17 (получен согласно схеме
3) комплексы Pd на
основе 13 были протестированы и в
аминировании 1,3-дифенилпроп-2-енил ацетата ди-н-пропиламином (схема 5, таблица
9) как в среде молекулярных растворителей (CH2Cl2, ТГФ), так и в
среде ионной жидкости ([bdmim]BF4).
|
опыт |
комплекс |
среда |
цикл |
конверсия, % |
ее, % |
|
1 |
17 |
ТГФ |
1 |
50 |
3 (+) |
|
2 |
17 |
CH2Cl2 |
1 |
90 |
60 (-) |
|
3 |
17 |
[bdmim]BF4 |
1 |
99 |
60 (-) |
|
4 |
17 |
[bdmim]BF4 |
2 |
92 |
61 (-) |
|
5 |
17 |
[bdmim]BF4 |
3 |
59 |
62 (-) |
|
6 |
18 |
ТГФ |
1 |
60 |
51 (-) |
|
7 |
18 |
CH2Cl2 |
1 |
90 |
65 (-) |
|
8 |
18 |
[bdmim]BF4 |
1 |
75 |
51 (-) |
|
9 |
18 |
[bdmim]BF4 |
2 |
45 |
52 (-) |
|
10 |
18 |
[bdmim]BF4 |
3 |
15 |
52 (-) |
Таблица 9.
При использовании комплексов 17,
18 ТГФ является худшим
растворителем, обеспечивая как меньшую конверсию, так и меньшую
энантиоселективность, причем в случае 17
наблюдается обращение конфигурации продукта. Использование ИЖ в качестве
растворителя по первому циклу способствовало достижению практически полной
конверсии (99%) и энантиоселективности сравнимой с
полученной в CH2Cl2.
Кроме того, дало возможность использовать катализатор повторно с незначительным
снижением конверсии (до 92%) и близкой к первому циклу энантиоселективностью
(таблица 9, опыты 3,4).
Лиганд 13 был протестирован в Pd-катализируемом аллильном амидировании 1,3-дифенилпроп-2-енил ацетата диформиламидом натрия (схема 16), открывая доступ к хиральным первичным аминам. При соотношении L/Pd=1/1 оптический вход составил 86% ee
с 47% конверсией.

Схема 16.
II. Р-Хиральные монодентатные ди- и триамидофосфиты.
II.1. Лиганды с ахиральными экзоциклическими заместителями.
Исходя из литературных
данных в области асимметрического катализа, можно предположить, что
перспективной будет являться группа монодентатных лигандов, обладающих P-хиральным
атомом фосфора. В этой связи был проведен синтез P*-амидофосфитов
(19 a-i, схема 17) из доступных
спиртов и аминов при взаимодействии с (2R,5S)-1,3-диаза-2-хлоро-3-фенил-2-фосфобицикло[3.3.0]октаном:

Схема 17.
Данные ЯМР 31Р показали, что лиганды 19a-c и 19h представлены
единственным стереоизомером, в то время как 19 d-g и 19i содержат от 2 до 26% второго P*-эпимера. Во
всех случаях основной стереоизомер имеет псевдоэкваториальную
ориентацию экзоциклического заместителя (R) при атоме фосфора, то есть имеет (R)-конфигурацию
хирального фосфорного центра, как следует из величин
КССВ 2Jc8,P в ЯМР13С
спектрах лигандов.
Тестирование лигандов 19a-i и их катионных
тетрафторборатных комплексов 20a,d -g (схема 18) в Pd-катализируемом сульфонилировании
1,3-дифенилпропен-2-ил ацетата пара-толуолсульфинатом натрия (схема 4, таблица 10)
показало, что наиболее результативными, с точки зрения энантиоселективности,
оказались системы на основе объемных диамидофосфитов 19d и 19f.
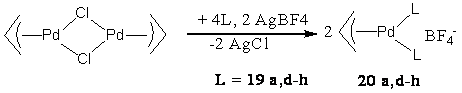
Схема 18.
|
опыт |
катализатор |
L*/Pd |
конверсия, % |
ee, % |
|
1 |
[Pd(allyl)Cl]2/19a |
1/1 |
17 |
83 (S) |
|
2 |
[Pd(allyl)Cl]2/19a |
2/1 |
16 |
81 (S) |
|
3 |
20a |
2/1 |
98 |
64(S) |
|
4 |
[Pd(allyl)Cl]2/19b |
1/1 |
72 |
84(S) |
|
5 |
[Pd(allyl)Cl]2/19b |
2/1 |
80 |
80(S) |
|
6 |
[Pd(allyl)Cl]2/19c |
1/1 |
28 |
13(S) |
|
7 |
[Pd(allyl)Cl]2/19c |
2/1 |
30 |
44(S) |
|
8 |
[Pd(allyl)Cl]2/19d |
1/1 |
32 |
94(S) |
|
9 |
20d |
1/1 |
44 |
97(S) |
|
10 |
[Pd(allyl)Cl]2/19e |
1/1 |
83 |
79(S) |
|
11 |
[Pd(allyl)Cl]2/19e |
2/1 |
97 |
86(S) |
|
12 |
20e |
2/1 |
20 |
85(S) |
|
13 |
[Pd(allyl)Cl]2/19f |
1/1 |
27 |
83(S) |
|
14 |
20f |
2/1 |
53 |
90(R) |
|
15 |
[Pd(allyl)Cl]2/19g |
1/1 |
27 |
76(S) |
|
16 |
[Pd(allyl)Cl]2/19g |
2/1 |
92 |
78(S) |
|
17 |
20g |
2/1 |
27 |
73 (S) |
|
18 |
[Pd(allyl)Cl]2/19h |
1/1 |
16 |
15(S) |
|
19 |
[Pd(allyl)Cl]2/19h |
2/1 |
16 |
13(S) |
|
20 |
[Pd(allyl)Cl]2/19i |
1/1 |
17 |
61(S) |
|
21 |
[Pd(allyl)Cl]2/19i |
2/1 |
18 |
59 (S) |
Таблица 10.
Реакция аллильного алкилирования диметилмалонатом (схема 2, таблица 11)
предъявила иные требования к стерическому фактору
лигандов.
|
опыт |
катализатор |
L*/Pd |
конверсия, % |
ee, % |
|
|
1 |
[Pd(allyl)Cl]2/19a |
2/1 |
98 |
97 (S) |
|
2 |
[Pd(allyl)Cl]2/19b |
2/1 |
16 |
70(S) |
|
3 |
[Pd(allyl)Cl]2/19c |
2/1 |
29 |
55(R) |
|
4 |
[Pd(allyl)Cl]2/19d |
2/1 |
35 |
82(S) |
|
5 |
[Pd(allyl)Cl]2/19e |
2/1 |
62 |
78(S) |
|
6 |
[Pd(allyl)Cl]2/19f |
2/1 |
28 |
86(S) |
|
7 |
[Pd(allyl)Cl]2/19g |
2/1 |
82 |
78(S) |
|
8 |
[Pd(allyl)Cl]2/19h |
2/1 |
20 |
62(R) |
|
9 |
[Pd(allyl)Cl]2/19i |
2/1 |
1 |
31 (S) |
Таблица 11.
В данном случае
наиболее эффективным является 19а, обладающий наименьшим экзоциклическим
заместителем (таблица 11). Причем дальнейшее увеличение заместителя приводит к уменьшению как конверсии, так и энантиоселективности
(таблица 11, опыты 2-7).
Лиганды 19a,d,f, наряду с
их катионными 20a,d,f и нейтральными комплексами 21 a,d,f (получены согласно схеме 6), были
использованы в качестве катализаторов реакции аллильного аминирования
1,3-дифенилпроп-2-енил ацетата ди-н-пропиламином в среде молекулярных растворителей (CH2Cl2
или ТГФ, схема 5, таблица 12) и ионной жидкости ([bdmim]BF4, таблица 13).
|
опыт |
катализатор |
растворитель |
конверсия,
% |
ее,
%* |
|
1 |
[Pd(allyl)Cl]2/19a |
ТГФ |
100 |
13 (+) |
|
2 |
[Pd(allyl)Cl]2/19a a |
CH2Cl2 |
100 |
19
(+) |
|
3 |
20a |
ТГФ |
100 |
1 (+) |
|
4 |
20a |
CH2Cl2 |
100 |
2 (+) |
|
5 |
21a |
ТГФ |
99 |
37
(+) |
|
6 |
21a |
CH2Cl2 |
100 |
50
(+) |
|
7 |
[Pd(allyl)Cl]2/19d |
ТГФ |
100 |
90 (+) |
|
8 |
[Pd(allyl)Cl]2/19d |
CH2Cl2 |
100 |
78 (+) |
|
9 |
20d |
ТГФ |
100 |
29 (+) |
|
10 |
20d |
CH2Cl2 |
100 |
11 (+) |
|
11 |
21d |
ТГФ |
99 |
65 (+) |
|
12 |
21d |
CH2Cl2 |
100 |
71 (+) |
|
13 |
[Pd(allyl)Cl]2/19f |
ТГФ |
99 |
77 (+) |
|
14 |
[Pd(allyl)Cl]2/19f |
CH2Cl2 |
100 |
74 (+) |
|
15 |
20f |
ТГФ |
97 |
74 (+) |
|
16 |
20f |
CH2Cl2 |
99 |
25 (+) |
|
17 |
21f |
ТГФ |
98 |
81 (+) |
|
18 |
21f |
CH2Cl2 |
100 |
75 (+) |
* в
скобках указан знак удельного вращения продукта реакции.
Таблица 12.
Применение данных каталитических систем в случае молекулярных растворителей
показало высокую конверсию, а максимальный оптический выход был получен на лиганде 19d (90% ее) при постановке каталитического эксперимента in situ. В ИЖ удалось достигнуть до 84%
ee
при использовании 20f, однако энантиомерный избыток снижается в последующем цикле
вместе с конверсией (таблица 13).
|
опыт |
цикл |
катализатор |
конверсия |
ее,
% |
|
1 |
1 |
20a |
100 |
3 (+) |
|
2 |
1 |
20d |
100 |
77 (+) |
|
3 |
2 |
20d |
71 |
75 (+) |
|
4 |
3 |
20d |
45 |
76 (+) |
|
5 |
1 |
20f |
100 |
84 (+) |
|
6 |
2 |
20f |
10 |
68 (+) |
Таблица 13.
II. 2. Диамидофосфиты с ионными ахиральными экзоциклическими
заместителями.
Одностадийным фосфорилированием соответствующих
ионных жидкостей и кватернизованного аминоспирта была получена новая
эффективная группа лигандов (22-24)
для Pd-катализируемого
аллильного замещения (схема 19).
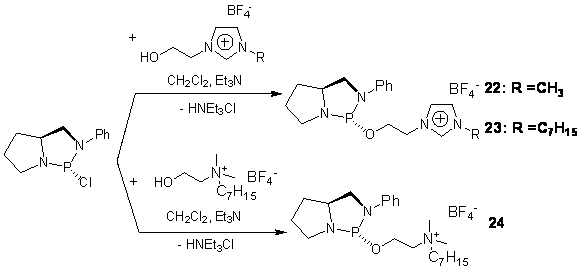
Схема 19.
С ионными диамидофосфитами 22-24 были синтезированыны
комплексы Pd(II) как с соотношением L/Pd =1/1 (22a-24a), так и
2/1 (22b-24b, схема 20) для тестирования в реакции Pd-катализируемого аллильного замещения.
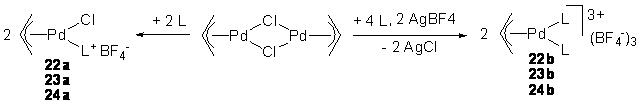
Схема 20.
В аллильном
алкилировании 1,3-дифенилпроп-2-енил ацетата диметилмалонатом (схема 2, таблица
14) лучшая энантиоселективность (93% ее) наблюдалась в случае использования
лиганда 22.
|
катализатор |
L*/Pd |
растворитель |
конверсия, % |
ee, % |
|
|
1 |
22a |
1/1 |
CH2Cl2 |
60 |
90 (S) |
|
2 |
22b |
2/1 |
CH2Cl2 |
66 |
45 (S) |
|
3 |
[Pd(allyl)Cl]2/22 |
2/1 |
CH2Cl2 |
89 |
93 (S) |
|
4 |
23a |
1/1 |
CH2Cl2 |
0 |
0 |
|
5 |
23b |
2/1 |
CH2Cl2 |
78 |
84 (S) |
|
6 |
[Pd(allyl)Cl]2/23 |
2/1 |
CH2Cl2 |
82 |
74 (S) |
|
7 |
24a |
1/1 |
CH2Cl2 |
65 |
20 (S) |
|
8 |
24b |
2/1 |
CH2Cl2 |
70 |
90 (S) |
|
9 |
[Pd(allyl)Cl]2/24 |
2/1 |
CH2Cl2 |
85 |
89 (S) |
Таблица 14.
В аминировании 1,3-дифенилпроп-2-енил
ацетата пирролидином (схема 11, таблица 15) максимальный оптический выход
составил 93% ее с участием комплекса 23а
(L=23).
|
опыт |
катализатор |
L*/Pd |
растворитель |
конверсия,
% |
ee, % |
|
1 |
22a |
1/1 |
ТГФ |
83 |
75 (R) |
|
2 |
22b |
2/1 |
ТГФ |
90 |
70 (R) |
|
3 |
[Pd(allyl)Cl]2/22 |
2/1 |
ТГФ |
95 |
90 (R) |
|
4 |
23a |
1/1 |
ТГФ |
45 |
93 (R) |
|
5 |
23b |
2/1 |
ТГФ |
100 |
77 (R) |
|
6 |
[Pd(allyl)Cl]2/23 |
2/1 |
ТГФ |
62 |
85 (R) |
|
7 |
24a |
1/1 |
ТГФ |
70 |
80 (R) |
|
8 |
24b |
2/1 |
ТГФ |
70 |
77 (R) |
|
9 |
[Pd(allyl)Cl]2/24 |
2/1 |
ТГФ |
70 |
90 (R) |
Таблица 15.
Простая замена нуклеофила на ди-н-пропиламин в
реакции аминирования 1,3-дифенилпропен-2-ил ацетата (схема 5, таблица 16)
позволила добиться уже 99% энантиоселективности при использовании тетрафторборатного комплекса 24b, что является лучшим на
сегодняшний день результатом для данной реакции как среди моно-,
так и бидентатных лигандов. Наиболее эффективный комплекс 24b был протестирован в этой реакции в
среде ионной жидкости (1-бутил-3-метилимидазолий тетрафторборат, [bmim]BF4), при этом
количественная конверсия наблюдается уже спустя 12 часов (в первом цикле),
однако заметно снижается энантиоселективность процесса (до 73% ее) ее по
сравнению с ТГФ. Кроме того, активность катализатора заметно падает при его повторном
использовании.
|
опыт |
катализатор |
L*/Pd |
растворитель |
конверсия,
% |
ee, % |
|
1 |
22a |
1/1 |
ТГФ |
94 |
82
(+) |
|
2 |
22b |
2/1 |
ТГФ |
70 |
15
(+) |
|
3 |
[Pd(allyl)Cl]2/22 |
2/1 |
ТГФ |
100 |
90
(+) |
|
4 |
23a |
1/1 |
ТГФ |
98 |
94
(+) |
|
5 |
23b |
2/1 |
ТГФ |
98 |
61
(+) |
|
6 |
[Pd(allyl)Cl]2/23 |
2/1 |
ТГФ |
100 |
97
(+) |
|
7 |
24a |
1/1 |
ТГФ |
70 |
93
(+) |
|
8 |
24b |
2/1 |
ТГФ |
95 |
99 (+) |
|
9 |
24b |
2/1 |
[bmim]BF4 |
100 |
73
(+) |
|
10 |
24b |
2/1 |
[bmim]BF4 |
35 |
74
(+) |
|
11 |
[Pd(allyl)Cl]2/24 |
2/1 |
ТГФ |
40 |
77
(+) |
Таблица 16.
Применение лигандов 22-24 и
комплексов на их основе в реакции сульфонилирования 1,3-дифенилаллилацетата пара-толуолсульфинатом
натрия (схема 4) также привело к получению высокой энантиоселективности (до 97%
ее, 72% конверсии в случае 23а).
II. 3. Диамидофосфитные лиганды с хиральными экзоциклическими
заместителями на основе БИНОЛ.
C целью синтеза
лиганда, способного приводить к высоким значениям энантиомерного избытка в
целом ряде асимметрических процессов, нами было предложено совместить высокую
каталитическую активность монодетатных лигандов
фосфитного типа на основе БИНОЛ и амидофосфитов,
обладающих (2R,5S)-3-фенил-1,3-диаза-2-фосфобицикло[3.3.0]октановым
фосфорным центром.
Новые лиганды 25 и 26 были получены
одностадийным фосфорилированием (S)- и (R)-1-(2-метоксинафталин-1-ил)нафталин-2-ола
(8) (Схема 21). Несмотря на то, что в P*-лигандах непосредственно после синтеза, согласно ЯМР 31Р,
содержалось небольшое количество эпимера с (S)-конфигурацией фосфорного центра, а это 3% (d = 125.7 (97%) и 118.4) для 25 и 6% для 26 (d = 128.9 (94%) и 119.6), простое
переосаждение из смеси гексана и хлороформа (95/5) позволило получить
стереоиндивидуальные диамидофосфиты 25 и 26.

Схема 21.
Взаимодействие
диамидофосфитов 25
и 26 с [Pd(allyl)Cl]2
(в присутствии AgBF4) и [Rh(COD)2]BF4 привело к получению катионных комплексов Pd(II) и Rh(I) (Схема 22).
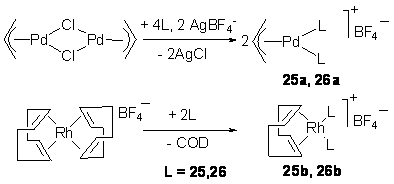
Схема 22.
В аллильном сульфонилировании с привлечением NaSO2pTol в качестве S-нуклеофила диамидофосфит
25 продемонстрировал отличную
активность (95%) и энантиоселективность 99% ее (схема 4, таблица 17).
Интересно, что диастереомерный лиганд 26 формирует
продукт с противоположной абсолютной конфигурацией и
более низкой энантиоселективностью. Скорее всего, в
данном случае оказала влияние неподходящая комбинация (2R,5S)-фосфоцентра и фрагмента (S)-Me-БИНОЛ.
|
опыт |
катализатор |
L/Pd |
растворитель |
конверсия
% |
ee,
% |
|
1 |
[Pd(allyl)Cl]2/25 |
1/1 |
ТГФ |
95 |
99 (R) |
|
2 |
[Pd(allyl)Cl]2/25 |
2/1 |
ТГФ |
91 |
95
(R) |
|
3 |
25a |
2/1 |
ТГФ |
95 |
92
(R) |
|
4 |
[Pd(allyl)Cl]2/26 |
1/1 |
ТГФ |
71 |
65
(S) |
|
5 |
[Pd(allyl)Cl]2/26 |
2/1 |
ТГФ |
63 |
73
(S) |
|
6 |
26a |
2/1 |
ТГФ |
90 |
86
(S) |
Таблица 17.
Использование
С-нуклеофила (диметилмалонат) позволило также
получить 99% энантиоселективность с высокой конверсией (схема 2, таблица 18).
Надо отметить, что используемый растворитель (ТГФ или хлористый метилен)
оказывает влияние на абсолютную конфигурацию продукта реакции (опыты 1-4).
|
опыт |
катализатор |
L/Pd |
растворитель |
конверсия, % |
ee, % |
|
1 |
[Pd(allyl)Cl]2/25 |
1/1 |
ТГФ |
71 |
99 (R) |
|
2 |
[Pd(allyl)Cl]2/25 |
1/1 |
CH2Cl2 |
76 |
85 (S) |
|
3 |
[Pd(allyl)Cl]2/25 |
2/1 |
ТГФ |
66 |
95 (R) |
|
4 |
[Pd(allyl)Cl]2/25 |
2/1 |
CH2Cl2 |
76 |
91 (S) |
|
5 |
25a |
2/1 |
ТГФ |
77 |
84 (S) |
|
6 |
25a |
2/1 |
CH2Cl2 |
99 |
98 (S) |
|
7 |
[Pd(allyl)Cl]2/26 |
1/1 |
ТГФ |
75 |
94 (R) |
|
8 |
[Pd(allyl)Cl]2/26 |
1/1 |
CH2Cl2 |
49 |
15 (R) |
|
9 |
[Pd(allyl)Cl]2/26 |
2/1 |
ТГФ |
77 |
95 (R) |
|
10 |
[Pd(allyl)Cl]2/26 |
2/1 |
CH2Cl2 |
54 |
13 (R) |
|
11 |
26a |
2/1 |
ТГФ |
79 |
94 (S) |
|
12 |
26a |
2/1 |
CH2Cl2 |
97 |
91 (S) |
Таблица 18.
В реакции аминирования 1,3-дифенилпроп-2-енил ацетата пирролидином был
достигнут 97% энантиомерный избыток с полной конверсией исходного субстрата
(схема 15, таблица 19), причем стереохимия продукта определяется, в данном
случае, исключительно амидофосфитным центром
лигандов.
|
опыт |
катализатор |
L/Pd |
растворитель |
конверсия, % |
ee, % |
|
1 |
[Pd(allyl)Cl]2/25 |
1/1 |
ТГФ |
81 |
94
(R) |
|
2 |
[Pd(allyl)Cl]2/25 |
2/1 |
ТГФ |
100 |
97 (R) |
|
3 |
25a |
2/1 |
ТГФ |
94 |
83
(R) |
|
4 |
[Pd(allyl)Cl]2/26 |
1/1 |
ТГФ |
95 |
57
(R) |
|
5 |
[Pd(allyl)Cl]2/26 |
2/1 |
ТГФ |
97 |
35
(R) |
|
6 |
26a |
2/1 |
ТГФ |
48 |
71
(R) |
Таблица 19.
В родственной реакции аминирования 1,3-дифенилпроп-2-енил ацетата ди-н-пропиламином
(схема 5, таблица 20), уже лиганд 26
предоставляет несколько больший оптический выход (95% ее), хотя и на 25 также достигнут высокий уровень
энантиоселективности (92% ее).
|
опыт |
катализатор |
L/Pd |
растворитель |
конверсия, % |
ee, % |
|
1 |
[Pd(allyl)Cl]2/25 |
1/1 |
ТГФ |
65 |
37 (+) |
|
2 |
[Pd(allyl)Cl]2/25 |
2/1 |
ТГФ |
100 |
51 (+) |
|
3 |
25a |
2/1 |
ТГФ |
68 |
92 (+) |
|
4 |
[Pd(allyl)Cl]2/26 |
1/1 |
ТГФ |
95 |
95 (+) |
|
5 |
[Pd(allyl)Cl]2/26 |
2/1 |
ТГФ |
65 |
93 (+) |
|
6 |
26a |
2/1 |
ТГФ |
64 |
74 (+) |
Таблица 20.
Показав высокую эффективность лигандов 25 и 26 с участием
1,3-дифенилпроп-2-енил ацетата как субстрата, мы решили протестировать их и в
реакции дерацемизации 1,3-дифенилпроп-2-енил этилкарбоната (схема 23), приводящей к получению оптически
чистого 1,3-дифенилпроп-2-ен-1-ола.
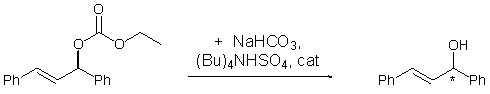
Схема 23.
Данный процесс обычно проводится в смеси CH2Cl2/H2O (9:1), однако
нами были использованы безводные условия с формированием соли (Bu)4NHCO3 in situ в органической среде. Этот
подход исключает агрессивную среду, которой является вода, что важно при
использовании достаточно чувствительных к гидролизу фосфорорганических
соединений. В этой реакции P*-хиральные диамидофосфиты 25 и 26 продемонстрировали также высокую активность (97-98%, таблица 21)
и энантиоселективность (95 и 96% ee)
при соотношении L/Pd
= 2/1.
|
опыт |
катализатор |
L/Pd |
конверсия, % |
ee, % |
|
1 |
[Pd(allyl)Cl]2/25 |
1/1 |
77 |
46 (R) |
|
2 |
[Pd(allyl)Cl]2/25 |
2/1 |
97 |
96 (R) |
|
3 |
[Pd(allyl)Cl]2/26 |
1/1 |
30 |
20 (R) |
|
4 |
[Pd(allyl)Cl]2/26 |
2/1 |
97 |
94 (R) |
|
5 |
26a |
2/1 |
98 |
95 (R) |
Таблица 21.
Тестирование катионных родиевых комплексов 25b, 26b на основе
диамидофосфитных лигандов 25 и 26 в гидрировании
диметилитаконата (схема 7) привело к высокому уровню энантиоселективности (90%
ее) при использовании 25b, комплекс 26b предоставил
более низкий результат (40% ее).
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И
ВЫВОДЫ
1. Для
асимметрического металлокомплексного катализа получено 27 новых монодентатных
лигандов трех структурных типов:
2. Показано, что
для новых фосфитных и амидофосфитных
лигандов наблюдается монодентатная координация по отношению
к таким предкатализаторам как [Pd(allyl)Cl]2, [Rh(COD)2]+BF4-.
3. Получены высокие энантиомерные избытки
для монодентатных лигандов фосфитного типа в Pd-катализируемом аллильном алкилировании 1,3-дифенилпроп-2-енил
ацетата диметилмалонатом (до 99% ее), в сульфонилировании
пара-толуолсульфинатом
натрия (до 99% ее), в аминировании пирролидином и пропиламином
(до 99% ее), в амидировании диформиламидом
натрия (до 86% ее), а также в реакции дерацемизации 1,3-дифенилпроп-2енил
этилкарбоната (до 96% ее). Высокая
энантиоселективность (до 99% ее) была достигнута в реакциях Rh-катализируемого
гидрирования прохиральных метиловых эфиров
ненасыщенных кислот с применением новых лигандов фосфитного типа.
4. Показана
возможность применения ионных жидкостей в качестве
реакционной среды при использовании металлокомплексных
катализаторов на основе лигандов фосфитного типа в асимметрическом катализе,
при этом значения энантиомерного избытка реакции аминирования 1,3-дифенилпроп-2-енил
ацетата ди-н-пропиламином
остаются неизменными в течение нескольких каталитических циклов.
Основные результаты диссертации изложены
в следующих публикациях:
1. K. N. Gavrilov, V. N. Tsarev, S. E. Lyubimov, A. A. Shiryaev, S. V. Zheglov, O. G. Bondarev, V. A. Davankov, A. A. Kabro, S. K. Moiseev, V. N. Kalinin. Chiral P*-monodentate phosphite ligand for Pd-catalysed asymmetric allylation
reactions. Mendeleev Commun. 2003, p.134-136.
2. V. N. Tsarev, S. E. Lyubimov, A. A. Shiryaev,
S. V. Zheglov, O. G. Bondarev,
V. A. Davankov, A. A. Kabro,
S. K. Moiseev, V. N. Kalinin,
K. N. Gavrilov. P-Chiral Monodentate Diamidophosphites - New and Efficient Ligands for
Palladium-Catalysed Asymmetric Allylic
Substitution. Eur. J. Org. Chem. 2004, p. 2214-2222.
3. K.N.
Gavrilov, S. E. Lyubimov,
S.V. Zheglov, E.B. Benetsky,
V.A. Davankov. Enantioselective Pd-catalysed allylation with
BINOL-derived monodentate phosphite and phosphoramidite
ligands. J. Mol. Catal. A:
Chemical, 2005, 231, p. 255–260.
4.
K. N. Gavrilov, S. E. Lyubimov,
P. V. Petrovskii, S. V. Zheglov,
A. S. Safronov, R. S. Skazov,
V. A. Davankov. Facile one-pot
synthesis of BINOL and H8-BINOL-based aryl phosphites
and their use in palladium-catalyzed asymmetric allylation.
Tetrahedron, 2005,
61, 10514-10520.
5. С. Е. Любимов, В. А. Даванков,
А. С. Кучеренко, С. Г. Злотин, С. В. Жеглов, К. Н.
Гаврилов, П. В. Петровский. Асимметрическое Pd-катализируемое аллильное
аминирование 1,3-дифенилаллилацетата дипропиламином в
молекулярных и ионных растворителях. Изв. АН. сер. хим., 2005,
№ 11, с.2478-2481.
6. S. E. Lyubimov, V. A. Davankov, K. N. Gavrilov. The use of an
ionic liquid in asymmetric catalytic allylic amination. Tetrahedron
Lett., 2006, 47, 2721–2723.
7. С. Е. Любимов, В. А. Даванков, П. М.
Валецкий, П. В. Петровский, М. Г. Максимова, К. Н. Гаврилов. Первый хиральный фосфит с четвертичным
аммониевым фрагментом:
синтез и
применение в асимметрическом Rh-катализируемом гидрировании. Изв. АН, сер. хим., 2006, № 8, с.1495-1498.
8. V.
N. Tsarev, S. E. Lyubimov, A. A. Shiryaev, S. V. Zheglov, O.
G. Bondarev, V. A. Davankov, A. A. Kabro, S.
K. Moiseev, V. N. Kalinin, K. N. Gavrilov. Monodentate Diamidophosphites,
bearing chiral phosphorus atom – new highly efficient ligands for Pd-catalised asymmetric allylic
substitution reactions. International conference dedicated to 50th anniversary of
A.N. Nesmeyanov Institute of Organoelement
Compounds, “Modern Trends in organoelement and
polymer chemistry, May 30- June 4, 2004,
Moscow, p. 144.
9. V. N. Tsarev,
S. E. Lyubimov, A. A. Shiryaev,
S. V. Zheglov, O. G. Bondarev,
V. A. Davankov, A. A. Kabro,
S. K. Moiseev, V. N. Kalinin,
K. N. Gavrilov . New efficient
ligands with chiral phophorus atom for Pd–catalysed asymmetric allylic
substitution. 16th International Symposium on Chirality, July 11-14, 2004,
New-York, USA, p. 109.
10. V. A. Davankov,
S. E. Lyubimov, S. Zheglov,
A. Safronov, K. Gavrilov. Facile one-pot synthesis of BINOL and H8-BINOL-derived
aryl phosphites and their use in palladium-catalyzed
asymmetric allylation. 17th
International Symposium on Chirality, 11-14 Sept., 2005, Parma, Italy, p. 126.
11. С.Е.Любимов, П.В Петровский,
В.А. Даванков, К.Н. Гаврилов, М.Г. Максимова, Е.Д. Лубуж, А.С. Кучеренко. Хиральные ионные фосфиты и диамидофосфиты как лиганды для асимметрического
металлокомплексного катализа. Международная конференция
по органической химии “Органическая химия от Бутлерова и Бейльштейна
до современности”, 26-29 июня, 2006, Санкт-Петербург, Россия, c. 531.