На правах
рукописи
РУДНЕВА
Татьяна
Николаевна
СИНТЕЗ,
ИССЛЕДОВАНИЕ
СТРОЕНИЯ И NO-ДОНОРНОЙ
АКТИВНОСТИ
НИТРОЗИЛЬНЫХ
КОМПЛЕКСОВ
ЖЕЛЕЗА
С
2-МЕРКАПТОИМИДАЗОЛАМИ
02.00.04 –
физическая
химия
АВТОРЕФЕРАТ
диссертации
на соискание
ученой
степени
кандидата
химических
наук
Черноголовка
- 2007
Работа
выполнена в
Институте
проблем химической
физики
Российской
Академии
Наук
Научный
руководитель:
д.х.н.,
профессор, академик
РАН
Алдошин
Сергей
Михайлович
Официальные
оппоненты:
доктор
биологических
наук,
профессор
Ванин
Анатолий
Федорович
доктор
химических
наук,
профессор,
член-корреспондент
РАН
Бачурин
Сергей
Олегович
Ведущая
организация:
ГОУ
ВПО
«Самарский государственный
университет»
Защита
состоится 28 мая
г.
Черноголовка,
проспект Ак.
Семенова Н.Н.,
д.1, корпус
общего
назначения
Института
проблем
химической
физики (КОН).
С
диссертацией
можно
ознакомиться
в библиотеке
ИПХФ РАН
г.
Черноголовка,
просп. ак.
Семенова Н.Н.,
д.1.
Автореферат
разослан 24
апреля
Ученый
секретарь
диссертационного
совета
доктор
химических
наук
Джабиев Т.С.
ОБЩАЯ
ХАРАКТЕРИСТИКА
РАБОТЫ
АКТУАЛЬНОСТЬ
РАБОТЫ. Открытие
монооксида
азота как
важнейшего
регулятора
многих
физиологических
процессов в
организмах
млекопитающих
и человека
явилось
одним из
значительных
достижений
современной
мировой
науки и привлекло
большое
внимание
исследователей
в области
химии,
биологии и
медицины.
Многие эффекты
воздействия NO в
организме
удалось
выявить
благодаря созданию
и
исследованию
экзогенных
доноров NO –
соединений,
способных в
ходе
метаболитических
процессов
генерировать
оксид азота.
Это хорошо
известные
нитроглицерин,
нитропруссид
натрия,
молсидомин,
нитрозоцистеин
и др. В
настоящее
время ведется
активный
поиск новых
доноров NO с целью
создания
лекарственных
препаратов
нового
поколения
для лечения
социально-значимых
заболеваний
(онкологических,
сердечно-сосудистых,
нейродегеративных)
с улучшенным
спектром
активности и
уменьшенными
побочными
эффектами по
сравнению с
уже используемыми
клиническими
препаратами.
На
сегодняшний
день
огромное
количество работ
так или иначе
касаются
темы
изучения
оксида азота.
Половина из
них
посвящена
синтезу
нитрозильных
металлокомплексов,
как наиболее
перспективных
NO-доноров.
В связи с
этим особое
внимание уделяется
синтезу
нитрозильных
комплексов железа
с
серосодержащими
лигандами,
поскольку
эти
соединения
образуются in vivo в
организмах
многих живых
существ,
начиная с
бактерий и
заканчивая
высшими
растениями и
млекопитающими.
Анализ
литературных
данных
показал, что
большинство
исследователей
считают, что
в живых
клетках
нитрозильные
комплексы с
серосодержащими
лигандами
существуют в
двух формах:
моноядерной
и биядерной,
находящихся
в
динамическом
равновесии,
которое
зависит от
концентрации
тиолов.
Однако, в
отличие от
моноядерных
комплексов,
так
называемых
динитрозильных
комплексов
железа (ДНКЖ),
легко
идентифицируемых
с помощью ЭПР-
спектров по
характерному
сигналу с g = 2,03,
строение
биядерных
комплексов in vivo
дискутируется,
и единого
мнения об
этом до сих
пор не
существует.
Некоторые
исследователи
полагают, что
в биядерных
комплексах
атомы серы
связывают
атомы железа
так же как в
«эфирах
красной соли
Руссена».
Есть и другое
мнение,
согласно
которому
биядерные
комплексы
представляют
собой
димерные
ассоциаты
моноядерных
нитрозильных
комплексов.
Однако,
литературных
данных по синтезу
и исследованию
именно
нитрозильных
железо-серных
комплексов
немного. Это
обусловлено,
в первую
очередь,
трудностями
выделения и
очистки, а
также
неустойчивостью
нитрозильных
комплексов in vitro.
Поэтому
получение и
исследование
нитрозильных
комплексов
железа с
серосодержащими
лигандами
представляет
трудную и,
несомненно,
важную
фундаментальную
задачу
установления
строения, корреляции
«структура –
свойство» и
изучения
свойств
спектральных
и
структурных
аналогов
нитрозильных
аддуктов
негемового железа
с тиолсодержащими
лигандами.
Это послужит
отправным
пунктом для
решения
прикладных
задач -
получения
новых
доноров
оксида азота
для биохимических
и
медицинских
исследований.
ЦЕЛЬ
РАБОТЫ: исследование
строения,
физико-химических
свойств и NO-донорной
активности
новых
нитрозильных
комплексов
железа с
2-меркаптоимидазолами,
являющихся
структурными
аналогами
природных
меркаптогистидинов.
Исследования
были
сосредоточены
на решении
следующих задач:
ü
разработка
методик
синтеза
новых нейтральных
биядерных
нитрозильных
комплексов
железа с
лигандами
структурного
ряда
2-меркаптоимидазола;
ü
изучение
молекулярной
и
кристаллической
структуры
методами
рентгеноструктурного
анализа,
мессбауэровской
и ИК-спектроскопии
и др.;
ü
исследование
магнитных
свойств
синтезированных
соединений;
ü
исследование
кинетики
образования NO и
нитрозильного
гемоглобина
при разложении
нитрозильных
комплексов
железа с 2-меркаптоимидазолами.
НАУЧНАЯ
НОВИЗНА
результатов,
выносимых на
защиту,
состоит в
следующем:
ü
впервые
была
получена
структура
анионного
тиосульфатного
нитрозильного
комплекса с
натриевым
катионом
(ТНКЖ) и
доказано, что
этот
комплексный
анион не
сохраняет
своей структуры
в протонных
средах: при
растворении
ТНКЖ в
протонных
растворителях
он распадается
на два
моноядерных
динитрозильных
тиосульфатных
комплекса
железа (ДНКЖтио),
который
далее
начинает
донировать
оксид азота;
ü
впервые
были
получены в
кристаллическом
состоянии
три новых
комплекса
состава [Fe2(SR)2(NO)4], где R –
лиганды
структурного
ряда
2-меркаптогистидина;
ü
впервые
была
получена структура
этих новых
нитрозильных
комплексов
методом РСА.
ü
впервые
были
проведены
магнитные
измерения
нитрозильных
комплексов
железа с 2-меркаптоимидазолами.
Было впервые
показано, что
железо
находится в
высокоспиновой
d7-конфигурации:
два из трех
неспаренных электронов
иона металла
полностью
спарены с
неспаренными
электронами
двух координированных
групп NO,
а оставшийся
неспаренный
электрон в
каждом из
фрагментов {Fe(NO)2}
связан
антиферромагнитным
взаимодействием
с
неспаренным
электроном
аналогичного
фрагмента
димерной
молекулы.
ü
впервые
исследованы
бимолекулярные
реакции
гемоглобина
с
синтезированными
комплексами
железа в
водных
растворах и
рассчитаны
константы
скорости
этих реакций;
ü
впервые
с помощью
микросенсора
amiNO-700 и
масс-спектроскопии
показано, что
нитрозильные
комплексы
железа
донируют оксид
азота
гидролитически
в протонных растворителях.
ПРАКТИЧЕСКАЯ
ЗНАЧИМОСТЬ.
Нитрозильные
комплексы
железа с
тиолсодержащими
азагетероциклическими
лигандами
обладают
рядом
преимуществ
перед другими
NO-донорами,
большинство
из которых
органические
нитраты и
нитриты,
требующие
участия
ферментов
для
донирования NO, что
делает их
неудобными
для
биологических
и
биохимических
исследований
и заставляет
исследователей
искать новые
доноры NO.
Нитрозильные
комплексы
железа
донируют
оксид азота
при
физиологических
значениях рН
без
какой-либо
активации (фото-,
термо- или
редокс-), их
можно
выделить в чистом
кристаллическом
состоянии, и
при разложении
этих
комплексов
не
образуется
никаких
токсичных
или
канцерогенных
веществ. Эти
комплексы
являются
моделями
активных центров
железо-серных
белков,
найденных во
всех живых
организмах
от бактерий
до млекопитающих.
Использование
в качестве
лигандов
природных
гетероциклов
дает возможность
дополнить
комплексы
новыми свойствами
либо усилить
действие
оксида азота.
Все это дает
основание
утверждать,
что на основе
нитрозильных
комплексов
железа можно
создать лекарственные
препараты
для терапии
социально-значимых
заболеваний
(сердечно-сосудистых,
онкологических,
нейродегеративных
и т.д.). Нитрозильные
комплексы
железа с
природными тиолами
могут
выступать
как
модельные объекты
для
фундаментальных
исследований
природы
связи металл
– NO
в
белках, а
также
процессов
депонирования
оксида азота
в клетках,
его
метаболизма
и механизмов
доставки NO до клеток–мишеней.
ЛИЧНЫЙ
ВКЛАД АВТОРА. Автором
диссертационной
работы были
разработаны
методики
синтеза
нитрозильных
комплексов
железа с
2-меркаптоимидазолами.
По
разработанным
методикам
получены три
новых
нитрозильных
комплекса с
лигандами
2-меркаптоимидазолами,
монокристаллы
этих
комплексов, а
также
монокристаллы
комплекса
ТНКЖ. Автором
была
разработана
методика
электрохимического
измерения
оксида азота,
выделяющегося
из
нитрозильных
комплексов
железа в 1%-ных
водных
растворах
ДМСО.
Рентгеноструктурные
эксперименты
проводили
к.ф.-м.н. Шилов
Г.В. и к.ф.-м.н. Чехлов
А.Н. (ИПХФ РАН).
Расшифровка
структур была
проведена
под
руководством
д.х.н. Головиной
Н.И. (ИПХФ РАН).
Мессбауэровские
спектры
регистрировались
к.ф.-м.н.
Ованесяном
Н.С. (ИПХФ РАН).
Спектры
оптического
поглощения
снимались
к.х.н.
Кондратьевой
Т.А. (ИПХФ РАН).
ИК-спектры
были
зарегистрированы
к.ф.-м.н.
Шульгой Ю.М.
(аналитический
центр ИПХФ
РАН),
масс-спектры
газовой фазы,
собранной
над
образцами
кристаллических
нитрозильных
комплексов,
выполнял Мартыненко
В.М.
(аналитический
центр ИПХФ
РАН), масс-спектры
водно-метанольных
растворов
ТНКЖ были
выполнены
к.ф.-м.н.
Сулеменковым
И.В. (ФИНЭП ХФ
РАН).
Магнитные
измерения
проводил
д.ф.-м.н.
Моргунов Р.Б.
(ИПХФ РАН).
Спектры поглощения
нитрозильного
гемоглобина
снимались
д.х.н.
Сырцовой Л.А.
(ИПХФ РАН). Элементный
анализ
синтезированных
в работе
соединений
был выполнен
Астаховой
А.С. (аналитический
центр ИПХФ
РАН).
АПРОБАЦИЯ
РАБОТЫ. Основные
результаты
работы
докладывались
на IV и V
Всероссийских
конференциях
молодых
ученых
«Современные
проблемы теоретической
и
экспериментальной
химии» (г.
Саратов, 2003, 2005), XVI
симпозиуме
по
химической
физике (г.
Туапсе, 2004), XXII
Международной
Чугаевской
конференции
по
координационной
химии (г.
Кишинев,
Молдова, 2005), III
Международном
конгрессе
«Биотехнология:
состояние и
перспективы
развития» (г.
Москва, 2005), IV
Национальной
кристаллохимической
конференции
(г.
Черноголовка,
Моск. обл., 2006),
конференции
«Научные
школы
Черноголовки
– молодежи»
(г.
Черноголовка,
Моск. обл., 2006), X
международной
конференции
«Мессбауэровская
спектроскопия
и её
применение»
(г. Ижевск, 2006), XXIV
Всероссийской
школы-симпозиума
молодых ученых
по
химической
кинетике (г.
Клязьма, Моск.
обл., 2006), III
Международной
конференции
«Высокоспиновые
молекулы и
молекулярные
магнетики»
(г. Иваново, 2006), 1ом
Европейском
химическом
конгрессе (г.
Будапешт,
Венгрия, 2006).
Материалы
работы
представлялись
на ежегодном
конкурсе
молодых ученых
им. С.М.
Батурина
(ИПХФ РАН), где
заняли третье
призовое
место в 2006 году
и второе в 2007.
ПУБЛИКАЦИИ. По теме
диссертации
опубликовано
18 печатных
работ: 8
статей в
отечественных
и зарубежных
журналах и 12
тезисов
докладов на
всероссийских
и
международных
конференциях.
ОБЪЕМ И
СТРУКТУРА
РАБОТЫ.
Диссертационная
работа
изложена на 130
страницах
машинописного
текста,
включая 12
таблиц и 46
рисунков (в
том числе 5
таблиц и 16
рисунков в
приложении).
Текст
диссертации
состоит из
введения, обзора
литературы,
экспериментальной
части и
обсуждения
результатов,
завершается
выводами,
списком
литературы (221
источник) и
приложением.
ОСНОВНОЕ
СОДЕРЖАНИЕ
РАБОТЫ
Во введении
обоснована
актуальность
темы и
практическая
значимость
работы,
сформулированы
цель и задачи
работы,
приведены
основные новые
научные
результаты.
Глава 1
диссертационной
работы
представляет
собой обзор
литературы.
В первой
части этой
главы
приводится
краткое
описание
физиологического
значения и
биохимии
оксида азота
и его форм,
методы определения
NO in
vivo и in vitro, а также
роль оксида
азота в неопластическом
процессе.
Во
второй части
приведены и
охарактеризованы
основные
классы
известных на
сегодня
эндогенных и
экзогенных
доноров
оксида азота.
Третья
часть
диссертации
посвящена
рассмотрению
места
нитрозильных
железо-серных
комплексов в
биохимии живых
организмов,
описаны
методы
синтеза этих
комплексов,
их строение и
свойства.
В
четвертой
части
проанализирована
информация о
координационной
способности,
биологических
свойствах и
роли
гетероциклических
тиолов ряда
имидазола в
синтезе нитрозильных
комплексов
железа.
Глава 2 состоит
из двух
частей и
содержит
описание
реактивов,
методик
синтеза
нитрозильных
комплексов
железа с
производными
2-меркаптоимидазола
и описание
физико-химических
методов
исследования
полученных
образцов
комплексов.
1. Реактивы.
Для
получения
газообразного
оксида азота
и комплексов
использовали FeSO4·7H2O (Aldrich),
Na2S2O3·5H2O (Aldrich),
NaNO2 (Aldrich),
HCl марки
«х.ч.» (ГОСТ 3118-77), имидазол-2-тиол
(Aldrich),
1-метилимидазол-2-тиол
(Aldrich),
имидазолидин-2-тион
(Aldrich). Для
работы
использовали
H2SO4 марки
«х.ч.» (ГОСТ 4204-77), KJ (Aldrich), CH2Cl2 (Aldrich),
а также
диэтиловый
эфир, ацетон,
метанол, этанол
и
дихлорметан,
абсолютизированные
по методу [1].
Все операции
по
приготовлению,
смешиванию
растворов и
выделению
комплексов
проводили в
атмосфере
чистого азота.
Для
приготовления
растворов
использовали
деаэрированную
дистиллированную
воду.
2. Методы
синтеза
сера-нитрозильных
комплексов
железа.
Натрий
μ2-дитиосульфатотетранитозилдиферрат
тетрагидрат
Na2[Fe2(μ-S2O3)2(NO)4]·4H2O (I) получился
в результате
реакции
сульфата железа
(II) c тиосульфатом
натрия в
присутствии
газообразного
монооксида
азота при
комнатной температуре.
Реакцию вели
в токе
монооксида
азота,
полученного
по методике [2]
и хранящегося
в газометре.
После того
как в
растворе
образовались
блестящие
чёрные
кристаллы,
реакционную
смесь выдерживали
ещё 15-20 ч при 6-8оС,
затем
кристаллический
осадок
отфильтровывался
и сушился на
воздухе в
течение суток.
Выход
I
составил 34,34%.
μ-N-C-S-бис(имидазол-2-тиолат)тетранитрозилдижелезо
[Fe2(С3Н3N2S)2(NO)4] (II), μ-N-C-S-бис(1-метил-имидазол-2-тиолат)тетранитрозилдижелезо
[Fe2(SС4H5N2)2(NO)4]
(III) и
μ-N-C-S-бис(имидазолидин-2-тиолат)тетранитрозилдижелезо
[Fe2(C3H5N2S)2(NO)4] (IV) были
получены по
схожим
методикам. Щелочной
раствор
тиола
добавлялся к
водному
раствору
смеси
комплекса I и
пятигидратного
тиосульфата
натрия. Мгновенно
выпадающий
аморфный
осадок отфильтровывался
через 20-30 минут.
Далее
полученный
порошок
перекристаллизовывался
из смесей
различных
органических
растворителей
и
высушивался
на воздухе.
Монокристаллы
всех трех
комплексов представляют
собой черные
блестящие
тонкие
игольчатые
пластинки.
Выход II: 86,23(%), III:
63,50(%), IV 18,46 (%).
Результаты
элементного
анализа
представлены
в таблице 1.
Таблица
1. Данные
элементного
анализа
комплексов I-IV(%)
|
№ |
С Эксп./теор. |
H Эксп./теор. |
N Эксп./теор. |
Fe Эксп./теор. |
S Эксп./теор. |
Na Эксп./теор. |
|
I |
- |
1.43 /
1.39 |
9.30 /
9.76 |
19.94 /
19.51 |
22.50 /
22.30 |
8.80 /
8.0 |
|
II |
16.71 /
16.74 |
1.70 /
1.39 |
22.20 /
26.00 |
26.15 /
26.05 |
13.16 /
14.08 |
- |
|
III |
20.83 /
20.96 |
1.31 /
2.18 |
24.73 /
24.45 |
24.15 /
24.45 |
14.16 /
13.97 |
- |
|
IV |
16.50 /
16.53 |
2.68 /
2.77 |
25.07 /
25.70 |
25.42 /
25.61 |
14.01 /
14.71 |
- |
3. Физико-химические
методы
анализа,
использованные
в работе
·
Рентгеноструктурный
анализ. Экспериментальные
массивы
отражений трех
соединений I-III получены
с
монокристаллов
на
четырехкружном
дифрактометре
КМ-4 («KUMA-Diffraction»,
Польша)
методом ω/2θ –
сканирования;
λКα = 0,71070
Å.
Кристаллические
структуры
решены прямым
методом (SHELX-97 [3]) и
уточнены в
полноматричным
МНК в анизотропном
приближении
неводородных
атомов. Поглощение
при
уточнении
структур не
учитывалось.
Атомы
водорода
молекул воды
в структуре
комплекса I
уточнялись в
изотропном
приближении,
также
уточнялись
заселённости
позиций атомов
О(6) и О(7) молекул
воды.
Заселённости
позиций этих
атомов
оказались
меньше целой
заселённости
позиций (<1).
Эти величины
составили 0,91 и
0,92. Факт неполной
заселенности
позиций
молекул воды
в кристалле
подтверждается
измерениями
параметров
элементарной
ячейки
кристаллов
из разных
синтезов.
Различия в
параметрах
выходят за
рамки
точности
измерений.
В
структуре II
атомы
водорода
уточнялись в
изотропном приближении.
Положение
атомов
водорода в
структуре III
было
рассчитано
геометрически,
их координаты
и тепловые
параметры не
уточнялись.
Параметры
элементарной
ячейки
кристалла и
трехмерных
набор
интенсивностей
отражений
для
комплекса IV получены
на
рентгеновском
автоматическом
дифрактометре
Enraf-Nonius CAD4 с
использованием
монохроматического
излучения MoKa (l = 0.71070 Å).
Интенсивности
всех
отражений
потом скорректировали
на
поглощение
полуэмпирическим
методом [4]:
максимальный,
минимальный
трансмиссионные
факторы = 0.868, 0.577.
Структура
была решена
прямым методом
и уточнена
полноматричным
методом
наименьших
квадратов
(МНК) в
анизотропном
приближении с
использованием
комплекса
программ SHELXS-97 [3]. Все
неводородные
атомы были
уточнены с учетом
анизотропных
тепловых
параметров.
Все
водородные атомы
были
объективно
локализованы
в разностном
синтезе
Фурье, а
положение
водородных
атомов при
атомах
углерода
были рассчитаны
геометрически
с уточнением
изотропных
тепловых
параметров,
положение
атома
водорода при
атоме азота
уточнялось
независимо.
Основные
кристаллографические
данные и характеристики
экспериментов
для комплексов
I-IV
представлены
в таблице 2.
·
ИК-спектры
регистрировали
Фурье-спектрометром
Perkin-Elmer Spectrum BX-II.
Образцы для
исследования
готовили в
виде
таблеток
(исследуемое
вещество – 1
мг, KBr - 200 мг).
·
Мессбауэровские
спектры
поглощения снимали
на установке WissEl,
работающей в
режиме
постоянного
ускорения.
Источником
служил Co57 в
матрице Rh.
Измерения
спектров при
низких
температурах
проводили с
помощью
проточного
гелиевого криостата
CF-506 (Oxford Instruments) с
регулируемой
температурой.
Обрабатывали
мессбауэровские
спектры
методом наименьших
квадратов в
предположении
формы Лоренца
индивидуальных
спектральных
компонент.
Таблица
2. Основные
кристаллографические
данные и характеристики
рентгенографического
эксперимента
для
комплексов I-IV
|
|
I |
II |
III |
IV |
|
Температура, К |
200 |
200 |
200 |
293 |
|
Сингония |
Моноклинная |
Моноклинная |
Моноклинная |
Триклинная |
|
Пространственная
группа |
P 2(1)/c |
P2(1)/n |
C2/c |
P1– |
|
Молекулярный вес |
574 |
430 |
458 |
434 |
|
a, Å |
11.22(4) |
7,473(1) |
14.455(3) |
6.422(2) |
|
b, Å |
10.44(4) |
12.928(3) |
9.848(2) |
7.618(2) |
|
c, Å |
7.62(2) |
8,173Å |
13.108(3) |
8.194(2) |
|
α, o |
90 |
90 |
90 |
100.93(2) |
|
β, o |
92.9(2) |
105,37(3) |
116.36(3) |
100.93(2) |
|
γ, o |
90 |
90 |
90 |
90.08(3) |
|
V, Å3 |
892(5) |
761.4(3) |
1671.9(6) |
386.2(2) |
|
z |
2 |
2 |
4 |
1 |
|
d,
г/см3
|
2.11(2) |
1.85 |
1.820 |
1.866 |
|
μ, mm-1 |
4.400 |
4.39 |
2.017 |
2.177 |
|
N1 (I>2σ(I)) |
1254 |
1215 |
765 |
1357 |
|
R1 (I>2σ(I)) |
0.091 |
0.040 |
0.0408 |
0.0321 |
|
wR1 |
0.116 |
0.130 |
0.0884 |
0.0503 |
·
Масс-спектры
газов,
выделяемых
исследуемым
образцом, регистрировали
с помощью
масс-спектрометра
МИ 1201В.
Ионизацию
газа в ионном
источнике
спектрометра
осуществляли
пучком
электронов с
энергией
70 эВ. Для
получения
газовой фазы
навеску
дейтерированных
ОНТ массой
около 80 мг
поместили в
кварцевую
ампулу
пиролизера,
соединенную
с системой напуска
масс-спектрометра
через
вентиль тонкой
регулировки.
Кварцевую
ампулу с образцом
откачивали в
течение часа
до давления
около 2·105 Па,
чтобы
удалить из
образца
поверхностные
и
слабосвязанные
примеси.
После
откачки ампулу
изолировали
от вакуумной
системы и
оставляли
при
комнатной
температуре (»20°С)
приблизительно
на сутки.
Затем
открывали
вентиль
тонкой
регулировки
и проводили масс-спектрометрический
анализ
собравшегося
в ампуле
газа. После
проведения
анализа
вентиль
тонкой
регулировки
закрывали, нагревали
образец до 65°С и
выдерживали
его при этой
температуре 1
час.
Собранный в
ходе этой
выдержки газ
анализировали,
сохраняя
температуру
образца неизменной. После
анализа
кварцевую
ампулу снова
откачивали
до высокого
вакуума,
закрывали
вентиль и
нагревали
образец до
следующей
температуры
(120°С).
Измерения
проводили в
интервале 1 £ m/z £ 120, где m –
атомная
масса, z - заряд
иона.
Масс-спектры
образцов
ТНКЖ в водных
растворах
получены с
помощью
времяпролетного
масс-спектрометра
высокого
разрешения с ортогональным
вводом ионов.
Для
экстракции ионов
из
приготовленных
образцов
использовался
электроспрейный
источник
ионов без
принудительной
подачи
раствора. В
качестве
газа завесы и
буферного
газа использовался
азот при
комнатной
температуре.
·
Магнитная
восприимчивость
комплексов
была
измерена с
помощью SQUID-магнетометра
фирмы «Quantum Design» в
интервале
температур 2 - 300
К в магнитном
поле 5 кЭ.
Зависимости
магнитной
восприимчивости
от
магнитного
поля
замечено не
было. В расчетах
парамагнитной
восприимчивости
комплекса
учитывался
диамагнитный
вклад равный
-230·10-6 см3/моль.
Эффективный
магнитный
момент вычислялся
по формуле ![]() , где
c -
молярная
парамагнитная
восприимчивость.
, где
c -
молярная
парамагнитная
восприимчивость.
·
Электрохимическое
определение NO. Для
измерения
концентрации
NO,
генерируемого
сера-нитрозильными
комплексами
железа I-IV в
растворах
использовали
сенсорный
электрод “amiNO-
Для
сравнения в
этих же
условиях были
изучены
другие NO-доноры:
“красная
соль
Руссена” Na2[Fe2S2(NO)4]·8H2O (V),
нитропруссид
натрия Na2[Fe(CN)5NO]·H2O (VI) и
диэтилентриамин-NO-ат
(VII) (C4H13N5O2) .
·
Реакции
нитрозильных
комплексов
железа с
гемоглобином
(Hb) в
водных
растворах
ДМСО / вода. Однородный
оксигемоглобин
выделялся из
свежей
человеческой
крови донора,
который
затем
использовался
для
получения
раствора Hb,
пропусканием
через
колонку с Sephadex G-25. Этот
раствор
замораживали
в виде шаров
в жидком
азоте. Перед
использованием
Hb размораживался
в сосуде
объемом 5 мл
под током
очищенного
азота. Рабочие
растворы
(буфер, ДМСО)
также сначала
очищали и
деаэрировали.
Для
регистрации
спектров
поглощения
использовался
спектрофотометр
Specord
М-40 (Carl Zeiss, Йена,
Германия),
снабженный
кюветами с
термореле. Спектры
записывались
при 25°С. Для
оценки
концентрации
HbNO, была
выполнена
обработка
спектров
поглощения
методом
наименьших
квадратов.
Вычисления
производились
в диапазоне
длин волн 450–650
нм.
Для
изучения
кинетики
образования NO,
генерируемого
комплексами
I-IV,
регистрировалось
изменение
спектров поглощения
систем
реакции,
содержащих
гемоглобин и
комплекс.
Поскольку
все сера-нитрозильные
комплексы
железа
поглощают в
видимой
области,
регистрировались
дифференциальные
спектры
поглощения
для экспериментальной
системы с
гемоглобином
и для системы
сравнения с
анаэробным
буфером (оба
раствора
содержали
соответствующий
комплекс той
же самой
концентрации).
Спектры
регистрировались,
начиная с 1.5
минуты после
начала реакции,
а затем с
3-минутными
интервалами.
Соблюдалось
уменьшение
поглощения
при 556 нм (максимум
поглощения Hb) и его
увеличения
при 545 и 575 нм.
Изменение
спектра
прекращалось
через 15-40 минут.
Для
сравнения в
этих же
условиях были
изучены
“красная
соль
Руссена” Na2[Fe2S2(NO)4]·8H2O
(V), нитропруссид
натрия Na2[Fe(CN)5NO]·H2O
(VI) и
диэтилентриамин-NO-ат
(VII) (C4H13N5O2).
Глава 3
посвящена
синтезу,
исследованию
физико-химических
свойств и NO-донорной
способности
тиосульфатного
нитрозильного
комплекса
железа как
исходного
соединения
для синтеза
нитрозильных
комплексов
железа с
2-меркаптоимидазолами.
Кристаллический
комплекс Na2[Fe2(S2O3)2(NO)4]·4H2O (I) был получен по
схеме (1):
(1)
![]()
Согласно
данным РСА
монокристалла
I (рис.1),
в биядерном
центросимметричном
анионе [Fe2(S2O3)2(NO)4]2-
атом железа
связан с
двумя
атомами
азота двух
групп NO и
другим
атомом
железа двумя
μ-атомами серы.
Мостиковые
атомы серы
связаны с
группировками
SO3.
Расстояние
между
тетраэдрически
координированными
атомами
железа
составляет 2.705(7)Ǻ,
что
указывает на
существование
сильного обменного
взаимодействия
между ними.
Комплекс
диамагнитен.
В структуре
обнаружены
две
независимых
молекулы
воды, т.е. на
биядерный
комплекс
приходятся
четыре молекулы
воды. В целом,
от кристалла
к кристаллу состав
воды
переменный.
Комплекс I в
твердофазном
состоянии
при
комнатной температуре
более
устойчив, чем
“красная соль
Русина” за
счет
образования
мостиковыми
атомами серы
трехцентровых
связей, что
приводит к
перераспределению
электронной
плотности в
тиосульфатном
анионном
комплексе по
сравнению с
сульфидными [Fe2S2(NO)4]2-.

Мессбауэровский
спектр
соединения I при T=80 K
имеет вид
одиночного
дублета, что
свидетельствует
о
единственном
состоянии
ионов железа
в структуре,
т.е.
ближайшая
координационная
сфера атомов Fe
в анионном
комплексе
состоит из
идентичных
атомов.
Значения
параметров
мессбауэровского
спектра 57Fe
для I -
изомерного
сдвига (dFe)
и
квадрупольного
расщепления (DEQ) –
близки к
таковым для
ранее
исследованных
солей с
дианионом [Fe2(m2-S2O3)2(NO)4]2-
(табл. 2) и
нейтральных
комплексов c
2-меркаптопиридином
и
2-меркаптопиримидином.
Уменьшение
почти вдвое
зарядовой s-плотности
на атоме
железа по
сравнению с дианионом
“красной
соли”
Руссена [Fe2S2(NO)4]2- (d=0.091(1) мм/с, DEQ=0.510(2)
мм/с) связано
с
электроакцепторными
свойствами
групп SO3. В
исследуемом
комплексе I
связь S(1)–S(2)
2.125(8) Å заметно
удлинена в
сравнении с
удвоенным
ковалентным
радиусом
серы.
По-видимому,
связь
ослаблена
из-за локализации
электронной
плотности на
кратных
связях S–O
и в окружении
иона железа.
В
тиосульфатном
комплексе
наблюдается
увеличение
длины связи Fe-S (2.257(8)
Å и 2.259(7) Å) и
укорочение
связей N-O (1.160(16) Å и
1.151(16) Å) по
сравнению с
таковыми в
сульфидных
комплексах,
где
соответствующие
величины
равны 2.23-2.24 Å и 1.175-1.179о.
Это может
свидетельствовать,
в рамках определенного
формализма, о
том, что
заряд на NO-группах
в комплексе I
становится
более
положительным,
чем в сульфидных
комплексах.
Можно формально
считать
заряд на NO-группах
нейтральным,
и тогда атом
железа в комплексном
анионе [Fe2(m2-S2O3)2(NO)4]2-
находится в
состоянии Fe+1
(d7).
Однако
комплекс I, как
и сульфидные
комплексы,
диамагнитен
вследствие
образования
связи Fe-Fe 2.705(7) Å.
Таблица 2. Параметры
мессбауэровских
спектров 57Fe
биядерных
нитрозильных
комплексов
железа
|
Соединение |
Координационный
узел |
Т, К |
δFe, мм/с |
ΔEQ, мм/с |
|
Na2[Fe2(S2O3)2(NO)4]·4H2O
(I) |
Fe{S2(NO)2} |
80 |
0.168(1) |
1.288 |
|
(Me4N)2[Fe2(S2O3)2(NO)4] |
Fe{S2(NO)2} |
78 |
0.163(1) |
1.241(1) |
|
(Et4N)2[Fe2(S2O3)2(NO)4] |
Fe{S2(NO)2} |
78 |
0.160(1) |
1.277(1) |
|
(n-Pr4N)2[Fe2(S2O3)2(NO)4] |
Fe{S2(NO)2} |
78 |
0.138(1) |
1.144(2) |
|
(n-Bu4N)2[Fe2(S2O3)2(NO)4] |
Fe{S2(NO)2} |
78 |
0.157(1) |
1.118(2) |
|
Fe2(SC5H4N)2(NO)4] Fe2(SC5H4N)2(NO)4] |
Fe{SS(NO)2} Fe{SS(NO)2} |
85 85 |
0.177(1) 0.169(1) |
1.262(2) 1.264(1) |
Анализ
масс-спектров
газовой фазы
над кристаллическим
образцом
комплекса I
показал, что
наиболее
интенсивным
пиком в спектре
газовой фазы
над образцом
комплекса I при
комнатной
температуре
(рис. 2 (1))
является пик
с m/z=18.
Этот пик
связан с
выделением в
газовую фазу
кристаллизационной
воды. Вторым
по интенсивности
является пик
с m/z=30,
обусловленный
выделением
молекул NO при
вакуумировании
нитрозильного
комплекса.
Имеется
также
небольшая
примесь
молекул СО и
СО2 (m/z = 28 и 44),
видимо,
захваченных
образцом из
воздуха.
Образование
молекул N2 и N2O,
скорее всего,
не
происходит,
поскольку
пик с m/z = 14(N+) в
спектре
имеет очень
малую
интенсивность,
а
интенсивности
пиков с m/z = 12(C+) и 16(O+)
достаточны,
чтобы
объяснить
фрагментацию
оксидов
углерода.
Если
образец,
газовыделение
из которого прекратилось
при
комнатной
температуре,
нагреть до 650С,
процесс
газовыделения
начинается
снова. При
этом помимо
молекул воды,
остающихся
основной
компонентой
газовой среды
в спектре
(рис. 2 (2)),
идентифицируются
ионы NO+ (пик
с m/z = 30) SO+ и SO2+
(пики с m/z = 48 и 64).
Это означает,
что при
описанных
условиях
образец не
только
продолжает
терять воду,
но и в
условиях
динамического
вакуума
начинается
незначительное
разложение
основного
вещества. Однако
ИК-спектр
образца
после такого
нагрева в
вакууме
практически
не меняется.
Это означает,
что процесс
разложения
коснулся небольшой
доли молекул
- возможно, на
поверхности
кристаллов.
Нагрев
комплекса до
более высокой
температуры
(980С)
приводит к
большему
выделению
азот- и серосодержащих
молекул в
газовую фазу
над образцом
(рис. 2 (3)). Таким
образом,
разложение
комплекса I с
образованием
азот- и
серосодержащих
продуктов
при Т<650С
является
весьма
незначительным
и лежит за
пределами
чувствительности
всех методов,
кроме
масс-спектрометрического.
![]()
 Данные
масс- и
ИК-спектроскопии
комплекса I ещё
раз
подтверждают,
что
присутствие
групп SO3 в
анионе [Fe2(S2O3)2(NO)4]2-
делает его
более
устойчивым
(скорее всего
вследствие
стерических
факторов) к
превращению
в
тетраядерный
комплекс [Fe4S3(NO)7]-.
Комплекс I относительно
устойчив при
хранении на
свету в
отсутствии
влаги. При
хранении
комплекса в
условиях повышенной
влажности
наблюдается
его заметное
разложение,
сопровождаемое
изменением
окраски и
кристалличности
и появлением
характерного
запаха.
Данные
масс- и
ИК-спектроскопии
комплекса I ещё
раз
подтверждают,
что
присутствие
групп SO3 в
анионе [Fe2(S2O3)2(NO)4]2-
делает его
более
устойчивым
(скорее всего
вследствие
стерических
факторов) к
превращению
в
тетраядерный
комплекс [Fe4S3(NO)7]-.
Комплекс I относительно
устойчив при
хранении на
свету в
отсутствии
влаги. При
хранении
комплекса в
условиях повышенной
влажности
наблюдается
его заметное
разложение,
сопровождаемое
изменением
окраски и
кристалличности
и появлением
характерного
запаха.
Анализ
спектров
поглощения
растворов (3,3х10-
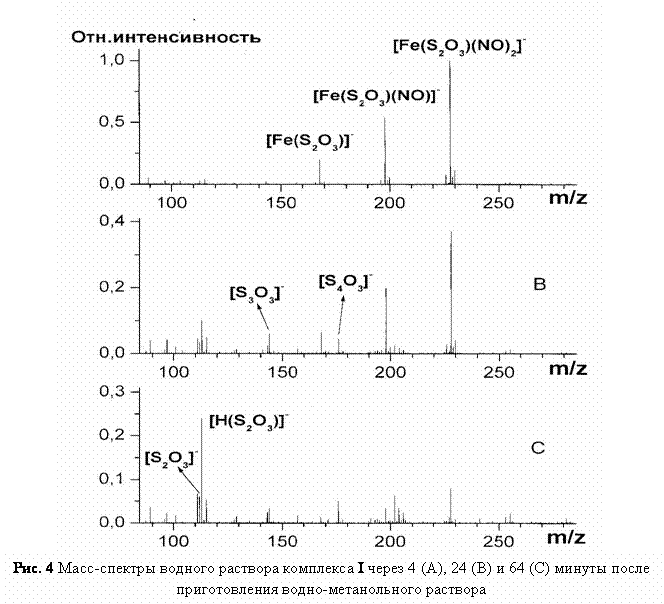
Масс-спектрометрия
водно-метанольного
(9:1) раствора
комплекса I концентрацией
1·10-
![]() (2)
(2)
 Генерация
NO
комплексом I
начинается
сразу же
после
растворения
и продолжается
в
Генерация
NO
комплексом I
начинается
сразу же
после
растворения
и продолжается
в  течение
часа.
Добавление к
комплексу I
избытка
тиосульфатного
аниона также
приводит к
образованию
ДНКЖтио. Но
генерация NO и
образование
мононитрозильного
интермедиата
и частицы [Fe(S2O3)]- из ДНКЖтио
начинается
только
спустя 40
минут после
растворения
комплекса I.
течение
часа.
Добавление к
комплексу I
избытка
тиосульфатного
аниона также
приводит к
образованию
ДНКЖтио. Но
генерация NO и
образование
мононитрозильного
интермедиата
и частицы [Fe(S2O3)]- из ДНКЖтио
начинается
только
спустя 40
минут после
растворения
комплекса I.
Глава 4 состоит
из двух
частей и
содержит
описание
синтеза и
физико-химических
свойств нитрозильных
комплексов
железа с
2-меркаптоимидазолами.
1. Синтез
и
исследование
молекулярного
и кристаллического
строения
нитрозильных
комплексов
железа с
2-меркаптоимидазольными
лигандами.
Наличие
в растворе
устойчивого
ДНКЖтио
дает
возможность
провести
реакции
обмена тиосульфатных
лигандов на
(3)
гетероциклические
с
образованием
биядерных
структур по
схеме:
![]()
Если
использовать
в качестве
тиолов производные
имидазол-2-тиола,
то по схеме (3)
образуются
нейтральные
биядерные
парамагнитные
нитрозильные
комплексы, в
которых
атомы железа
связаны друг
с другом
через
структурный
фрагмент μ-N-C-S (рис. 5). При
этом следует
соблюдать рН
реакционной
среды: его
значение не
должно
превышать рКа
тиолов, иначе
происходит
образование
гидроксида
железа (III).
В настоящей
работе были
синтезированы
три биядерных
парамагнитных
тетранитрозильных
комплексов
железа с
имидазол-2-тиолом
(II),
1-метилимидазол-2-тиолом
(III) и
имидазолидин-2-тионом
(IV). По
данным
мессбауэровской
спектроскопии,
полученные
по схеме (3)
порошки содержали
помимо фаз с
параметрами,
соответствующими
комплексу,
железосодержащую
примесную
фазу.
Примесные
фазы
октаэдрического
Fe3+ с
аналогичными
и близкими
значениями
мессбауэровских
параметров были
обнаружены и
ранее при
синтезе
биядерных
нитрозильных
железо-серных
комплексов с
другими
азагетероциклическими
лигандами [5].
При этом содержание
примесной
фазы не
превышает,
как правило, 10%.
Исключением
является
комплекс IV,
где
содержание
примесной
фазы в
среднем составляет
около 50%. Для
выделения
монокристаллов
нитрозильных
комплексов II-IV проводилась
перекристаллизация
полученных
при синтезе
порошков из
смесей
органических
растворителей.
Для
производных
меркаптоимидазола,
согласно
литературным
данным,
возможна
монодентатная,
бидентатная
и мостиковая
координация
атома
металла.
Помимо
способа координации
представлялось
особенно важным
выяснить в
какой форме
(тиольной или
тионной)
лиганды
координируют
атом металла,
учитывая, что
один из
используемых
в синтезе
лигандов
(имидазолидин-2-тион)
в твердофазном
состоянии
существует
как тион,
тогда как другие
два – в форме
тиолов.
По
данным РСА
все три
комплекса
имеют центросимметричную
биядерную
структуру
(рис. 5 (а)), в
которой оба
атома железа
соединены ковалентно
с атомом серы
одного
лиганда и донорно-акцепторной
связью с
атомом азота
другого
лиганда через
фрагмент μ-S-C-N.
Расстояния
Fe…Fe
составляют 4,102 Ǻ;
4,010 Ǻ и 4.030 Ǻ,
соответственно
в комплексах II, III и
IV. Длины
связей С-S в
обсуждаемых
комплексах 1,740(4)
Ǻ; 1,729Ǻ и 1,741Ǻ
превышают
справочное
значение
длины
двойной
связи C=S (1.684 Ǻ) в
среднем на 0,06 Ǻ,
что делает
возможным
предположение
об одинарной
связи C-S во всех
обсуждаемых
комплексах,
несмотря на
то, что в
синтезе
комплекса III участвует
лиганд в
тионной
таутомерной
форме.

Значения
длины связи
С(1)-N(3) 1.314(4) Å в
комплексе II существенно
меньше, чем
для C(1)-N(4) 1.344(5) Å, С(31)-N(31) 1.385(5) Å и C(2)-N(4) 1.360(5)
Å. Длина
кратной
связи С-С
лиганда
составляет
величину 1.365(5) Å, что
соответствует
сумме
радиусов
атомов
углерода, характерной
для
промежуточного
между двойным
и одинарным
типами связи.
Анализ остальных
связей в
гетероцикле
также указывает
на сильную
делокализацию
π-электронов
внутри
кольца.
Однако,
распределение
длин связей и
углов в
тиоимидазольном
кольце
наиболее
близко к
тиольной
форме лиганда.
В комплексе III
наблюдается
аналогичная
картина:
несколько
сокращенные
длины связей N(3)-C(1)
1.333(7)Å, C(2)-C(3) 1.347(8)Å, по
сравнению с
другими в
этом цикле N(4)-C(1)
1.356(6)Å, N(3)-C(3) 1.394(6)Å, N(4)-C(2)
1.367(7)Å.
Вследствие
неароматичности
кольца в имидазолидин-2-тионе
в комплексе IV
немного
другое
распределение
длин связей в
лигандном
цикле,
указывающее
на
распределение
π-электронной
плотности
только между атомами
N(1), C(2) и N(3).
Анализ
длин связей в
структурном
фрагменте {Fe(NO)2}
показал, что
длины связей N(1)-O(1) и N(2)-O(2) в
комплексе II близки к
таковым для
комплекса III, но
значительно
короче
аналогичных
связей в
комплексе IV с
имидазолидин-2-тионом.
И наоборот,
длины связей Fe(1)-N(1) и Fe(1)-N(2) в
комплексе II схожи с
длинами
таких же
связей
комплекса IV, но
отличаются
от тех, что в
комплексе III: связь Fe(1)-N(1) в
комплексе III длиннее,
а связь Fe(1)-N(2)
короче.
Таблица
3. Значения
основных
длин связей,
углов и параметров
мессбауэровской
57Fe
(при
290К) и
ИК-спектроскопии
сера-нитрозильных
комплексов
железа II-IV состава Fe2(SL)2(NO)4.
|
N |
L |
N-O, Å |
Fe-N, Å |
Fe-N-O,0 |
Fe-Nц, Å |
Fe…Fe, Å |
Fe-S, Å |
dFe*,
мм/c |
DEQ**,
мм/c |
nNO, cм-1 |
DnNO, cм-1 |
|
II |
|
1.148(4) 1.158(5) |
1.690(3) 1.674(3) |
165,5 (4) 170.5 (4) |
2.010(3) |
4.102 |
2.299(1) |
0.196(1) |
1.109(2) |
1781 1748 1716 |
65 |
|
III |
|
1.149(6) 1.164(6) |
1.696(5) 1.667(5) |
164.3(5) 170.2 (4) |
2.013(4) |
4.010 |
2.283(2) |
0.180(1) |
0.928(2) |
1782 1748 1716 |
66 |
|
IV |
|
1.165(3) 1.170(3) |
1.687(3) 1.673(3) |
167.2(3) 170.7(3) |
1.982(2) |
4.030 |
2.312(1) |
0.155(4) |
1.015(1) |
1786 1724 |
62 |
*dFe -
изомерный
сдвиг
относительно
a-Fe
**DEQ -
квадрупольное
расщепление
При
этом
величины
валентных
углов Fe(1)N(1)O(1) и Fe(1)N(2)O(2)
практически
одинаковы
для всех трех
комплексов.
Такое
отличие в NO-группах
можно
объяснить
разницей в
распределении
частичных
зарядов на
нитрозильных
группах: чем
ближе угол Fe-N-O к
линейному и
короче связь Fe-N,
тем более
положителен
заряд на NO-фрагменте
[6].
В ИК -
спектрах
комплекса IV, в
отличие от II и III,
для которых
характерны
три полосы
поглощения NO, в
соединении IV
обнаружены
две полосы
поглощения NO групп
(табл. 3).
Расщепление
полос может
быть связано
с
неэквивалентностью
NO-групп в Fe-N-O
фрагментах.
Частоты
валентных
колебаний NO групп
комплексов II-IV
находятся в
области
более
высоких
значений,
что, в рамках
определенного
формализма [6]
и в
совокупности
с
полученными
данными РСА,
свидетельствует
о cмещении
электронной
плотности с NO групп на Fe. Таким
образом,
заряд на NO
становится
более
положительным,
и электрофильная
активность Fe(NO)2
фрагментов
комплексов
увеличивается.
В целом
значения
валентных
колебаний
нитрозильных
групп
комплексов μ-N-C-S
типа более
высоки, чем μ2-S-комплексов.
Наблюдаемое
в IV
существенное
уменьшение
длины связи
железа с
атомом азота
гетероцикла
и межатомного
расстояния Fe…Fe
(на 0.072Å по
сравнению с
таковым в II) (табл. 3)
позволяют
предположить,
что комплекс
с
имидазолидин-2-илом
будет более
устойчивым,
чем
комплексы II и III в
протонных
средах.
Данные
Мессбауэровской
спектроскопии
хорошо
согласуются
с данными
РСА. Мессбауэровские
спектры
комплексов
имеют вид одиночного
дублета, что
говорит о
структурной
эквивалентности
атомов
железа. В
ряду от II к III и IV
наблюдается
уменьшение
значения
изомерного
сдвига δFe (табл. 3),
которое
происходит
из-за
увеличения
плотности s-электронов
на ядрах
железа и,
вследствие этого,
укорочения
связи Fe-S. Однако, в
комплексе IV
мы наблюдаем
некоторое
увеличение
длины связи Fe-S.
Этот факт,
по-видимому,
связан с тем,
что отрицательный
заряд на S-
имидазолидин-2-ила
отличается
от таковых на
имидазол-иле
комплекса II и
1-метил-имидазол-2-иле
комплекса III,
содержащих, в
отличие от IV, ароматический
цикл.
При этом
значения
изомерных
сдвигов этих
трех
комплексов почти
вдвое больше
по сравнению
со сдвигами
для
комплексов
со
структурой μ2-S, что
говорит о
более
длинной
связи Fe-S.
Кристаллические
структуры
(рис. 5 (б)) исследованных
комплексов
во многом
схожи. Как видно
из рисунков,
все они
образованы
слоями,
параллельными
плоскости bc. В
комплексах II и IV между
молекулами
одного слоя
существуют межмолекулярные
контакты
атома серы и
фрагмента H-N в
кольце
лиганда. Эти
контакты
составляют 2.721 Ǻ
и 2,606 Ǻ,
соответственно.
В структуре
комплекса III водород
при атоме
азота
замещен на
метильную
группу. Но и
здесь
существует
контакт атома
серы и C-H
метильной
группы 2,815 Ǻ. Во
всех трех
структурах
молекулы
разных слоев
ориентированы
друг к другу NO-группами.
Расстояние
между слоями
порядка 3Ǻ. По
всей
видимости,
слои связаны
между собой
электростатическими
силами.
2. Магнитные
свойства
нитрозильных
комплексов
железа с
2-меркаптоимидазольными
лигандами.
 Исходя
из d7-конфигурации
атома железа
и учитывая,
что расстояние
Fe…Fe превышает
4 Å, можно было
ожидать, что
комплексы II-IV будут
парамагнитны.
Действительно,
они, в отличие
от
диамагнитных
μ2-S-замещенных
тиосульфатных
и тиолатных
комплексов,
дают
ЭПР-сигнал.
Исходя
из d7-конфигурации
атома железа
и учитывая,
что расстояние
Fe…Fe превышает
4 Å, можно было
ожидать, что
комплексы II-IV будут
парамагнитны.
Действительно,
они, в отличие
от
диамагнитных
μ2-S-замещенных
тиосульфатных
и тиолатных
комплексов,
дают
ЭПР-сигнал.
Зависимости
магнитной
восприимчивости
χ(Т) для
комплексов II-IV имеют
характерный
для димеров
явно выраженный
максимум при
температурах
63, 85 и 83 К, соответственно.
При низких
температурах
наблюдается
небольшое
повышение
магнитной восприимчивости,
вызванное
наличием в образцах
парамагнитных
частиц
другого сорта.
Кривые μэфф(Т)
при высоких
температурах
стремятся к
значению ~2,5b, что
близко к
теоретическому
значению 2,45b (при
g=2 g(2(S+1)S1/2=2.45))
для двух
слабовзаимодействующих
неспаренных
электронов c S=1/2. Для
примера на
рис. 6
приведены
зависимости
магнитной
восприимчивости
и
эффективного
магнитного
момента от
температуры для
комплекса IV.
Зависимости
χ и μэфф от Т
для
комплексов II и III
имеют
аналогичный
вид.
Конфигурация
железа 3d7 (степень
окисления +1) в
тетраэдрической
координации
имеет спин S=3/2,
образованный
тремя
неспаренными
электронами,
локализованными
на dp-орбиталях.
Суммарный
спин
парамагнитного
центра
образован
отдельным
ионом Fe(d7) (S=3/2) и
двумя
связанными
с ним NO-группами (S=1/2). За
счет сильных
обменных
взаимодействий
p*-NO электронов
с dp-электронами
Fe,
суммарный
спин
парамагнитного
центра St=1/2, что
находится в
соответствии
с теоретическими
расчетами
Энемарка и
Фелтама [7]
Немонотонную
зависимость
магнитной
восприимчивости
образцов
комплексов
от температуры
можно
объяснить
суммированием
вкладов в
полный
магнитный
момент
«примесных»
парамагнитных
частиц со
спином 3/2 и
димеров с
парой спинов ½. Доля
«мономерной
примеси» не
превышает 2%. Вклад
примеси в
полный
магнитный
момент и зависимость
ее
восприимчивости
описывается
законом
Кюри-Вейса.
Димеры
содержат
пары спинов
железа,
которые
способны
взаимодействовать
друг с
другом. При
понижении
температуры
полный спин
димеров
уменьшается
из-за обменного
взаимодействия
антиферромагнитного
типа между
ними. Этим
объясняется
спад магнитной
восприимчивости
при
температурах
ниже 75 К. С
дальнейшим
понижением
температуры
все большее
число
димеров
имеют
спаренные
спины,
находясь при
этом в
основном
состоянии со
спином
комплекса,
равным нулю,
характерным
для
тетраэдрического
окружения [8]. При
этом
возрастает
вклад
парамагнитной
примеси,
приводя к
нарастанию М
при Т < 10 К.
Экспериментальная
зависимость
χ(Т) с приемлемой
точностью
аппроксимируется
суммой двух
выражений,
первое из которых
представляет
собой
выражение
Блини-Бауэрса
[9] для магнитной
восприимчивости
димера с
двумя спинами
½, а второе
учитывает
наличие
парамагнитных
частиц со
спином 3/2
(соотношение
Кюри-Вейса):
 ,
(4)
,
(4)
где
N – число
магнитных
центров в
рассматриваемом
образце; μВ
– магнетон
Бора; g – g-фактор;
k –
постоянная
Больцмана; T –
температура; J - обменный
интеграл; p –доля
парамагнитных
частиц со
спином 3/2 в образце; C –
постоянная
Кюри, θ-
постоянная
Вейса.
Таким
образом, если
исходить из
высокоспиновой
d7-конфигурации
железа, то
при 2-300 K два
из трех
неспаренных
электронов
иона металла
полностью
спарены с
неспаренными
электронами
двух
координированных
групп NO,
а оставшийся
неспаренный
электрон в
каждом из
фрагментов {Fe(NO)2}
связан
антиферромагнитным
взаимодействием
с
неспаренным
электроном
аналогичного
фрагмента
димерной
молекулы.
Кривые
зависимости
магнитной
восприимчивости
от
температуры
для
моноядерных
комплексов с
гетероциклическими
тиольными
лигандами [10]
имеют
нормальный
вид, резко возрастая
при 2 К, что
говорит о
присутствии
в образце
одного сорта
частиц, и
подтверждая
ранее
высказанные
предположения.
Глава 5 состоит
из трех
частей. В ней
описываются
данные,
полученные в
ходе
изучения NO-донорной
активности
нитрозильных
комплексов
железа.
1. Масс-спектры
газовой фазы
при разложении
поликристаллов
нитрозильных
комплексов
железа с
2-меркаптоимидазолами
В
отличие от
комплекса I,
соединения II, III и IV оказались
достаточно
устойчивыми
в вакууме при
комнатной
температуре.
Давление собранных
в ходе
выдержки
образцов в
вакууме
газов практически
не превышало
уровень
остаточных
газов в
масс-спектрометре.
Основным компонентом
выделенного
газа
комплексом II являются
молекулы NO (ион с m/z
=30). Кроме этого
пика на
масс-спектре
можно видеть
также пики с m/z = 14
([N]+), 18 ([H2O]+),
28 ([CO]+ и/или [N2]+)
и 44 ([CS]+
и/или [CO2]+).
Происхождение
ионов [N]+
в спектрах
комплексов
не вызывает
сомнения –
азот входит в
состав
нитрозильной
группы;
появление
слабоинтенсивных
полос [H2O]+ можно
объяснить
наличием
адсорбционной
воды.
Молекулы CO, CO2 и N2, в
принципе,
могут
захватываться
при контакте
образца с
воздухом.
Однако,
захваченные
и,
следовательно,
слабосвязанные
молекулы
должны были
бы
выделиться в
газовую фазу
при
вакуумировании.
Но они не
проявились в
спектре
газов,
полученных
при выдержке
образца в
вакууме без
нагрева.
Можно думать,
что пики с m/z = 24
и 44
обусловлены
фрагментами
имидазола C3H3N2S
([N2]+)
и ([CS]+).
Подтверждением
точки зрения
о возможном переходе
в газовую
фазу лиганда
или продуктов
его распада
является
также присутствие
в спектре
пиков с m/z
= 45 ([HCS]+) и 46 ([H2CS]+).
Однако
других
фрагментов
лиганда в
спектре
этого
образца не
обнаруживается.
Нагрев
до 70°С не
приводит к
заметной
газификации
образца
комплекса III,
который
оказался
более
устойчивым,
чем комплекс II.
При нагреве
от 20 до 70°С в
спектре
комплекса IV
наблюдается
появление
интенсивных
полос с m/z = 30, 28, 18,
14, 44, отвечающие
молекулярным
ионам [NO]+,
[CO]+, [H2O]+,
[N]+, [CS]+,
соответственно;
среди
которых
наиболее интенсивный
пик
молекулярного
иона [NO]+.
Нагрев с 70
до 120oС
интенсифицировал
газификацию
всех образцов,
кроме
образца
комплекса IV,
который,
по-видимому,
уже частично
разложился
ранее при
температурах
20-700С.
Для
комплекса II
состав
газовой фазы
не меняется,
но давление
выделившегося
газа
существенно
возрастает.
Для образца
комплекса III в
этом
температурном
интервале
наблюдается
спектр
газовой фазы
с наибольшим
числом пиков.
Помимо
молекул NO и H2O в
газовой фазе
присутствуют
в заметном количестве
молекулы
тиольного
лиганда или продукты
его
разложения.
Таким
образом,
методом
масс-спектроскопии
установлено,
что
комплексы
являются устойчивыми
при
вакуумировании
при температуре
200С.
Основными
компонентами
газовой фазы
при нагреве
свыше 200С
являлись NO (с
максимальным
значением
интенсивностей
пиков), H2O и
молекулярные
ионы,
отвечающие
фрагментам
их тиольных
лигандов.
2. Реакции
нитрозильных
комплексов
железа с
гемоглобином
в растворах ДМСО /
вода
 Известно,
что
гемоглобин (Hb)
взаимодействует
с NO
c образованием
нитрозильного
гемоглобина (HbNO). Спектр
поглощения
гемоглобина
с характерной
полосой в
видимой
области lmax = 556
нм (e =12.5 мМ-1·cm-1)
преобразуется
в спектр
нитрозильного
гемоглобина
с λmax = 545 нм, (ε = 12.6 мМ-1·cm-1)
и λmax = 575 нм (ε=13.0 мМ-1·cm-1)
(значения ε
отнесены на
один гем
человеческого
гемоглобина).
Характеристический
спектр
образования HbNO в ходе
реакций
комплекса IV с гемоглобином
представлен
на рисунке 7.
На рисунке 8
представлены
данные
кинетики
взаимодействия
комплекса IV с Hb.
Известно,
что
гемоглобин (Hb)
взаимодействует
с NO
c образованием
нитрозильного
гемоглобина (HbNO). Спектр
поглощения
гемоглобина
с характерной
полосой в
видимой
области lmax = 556
нм (e =12.5 мМ-1·cm-1)
преобразуется
в спектр
нитрозильного
гемоглобина
с λmax = 545 нм, (ε = 12.6 мМ-1·cm-1)
и λmax = 575 нм (ε=13.0 мМ-1·cm-1)
(значения ε
отнесены на
один гем
человеческого
гемоглобина).
Характеристический
спектр
образования HbNO в ходе
реакций
комплекса IV с гемоглобином
представлен
на рисунке 7.
На рисунке 8
представлены
данные
кинетики
взаимодействия
комплекса IV с Hb.
Все
кинетические
закономерности
хорошо описываются
в рамках
формализма
реакций псевдопервого
порядка. Были
построены теоретические
моноэкспоненциальные
кривые,
используя
функцию
![]() (5)
(5)
где k –
эффективная
константа
скорости первого
порядка, а –
конечная
концентрация
HbNO.
Эффективные
константы
скорости
первого порядка
(k) для
изученных
реакций
показаны в
таблице 4.
Скорость
взаимодействия
гемоглобина
с NO близка
к скорости
диффузии (константа
скорости для
реакции
второго порядка
– 1.02·108 М-1·s-1
[11]). Исходя из значений
k, которые
были
получены для I-V (Таблица
4), можно
предположить,
что скорость
образования HbNO в
экспериментах
определяется
стадией генерации
NO из
комплексов I-V.
Следовательно,
образование
HbNO может быть описано
двумя
последовательными
реакциями.
Первая
реакция –
разложение
комплексов I-V с
Таблица 4.
Эффективные
константы
скорости
первого порядка
(k)
взаимодействия
комплексов I-V с Hb*.
|
|
Комплекс |
k, с-1х·103 |
|
I |
Na2[Fe(S2O3)2(NO)2]×4H2O |
4.5 ± 0.45 |
|
II |
[Fe2(С3Н3N2S)2(NO)4] |
7.4 ± 0.74 |
|
III |
[Fe2(SС4H5N2)2(NO)4] |
8.85 ± 0.9 |
|
IV |
[Fe2(SС3H5N2)2(NO)4] |
57.0 ± 0.57 |
|
V |
Na2[Fe2S2(NO)4]×8H2O |
0.061 ±
0.006 |
*Концентрация
комплексов I-V 2·10-
выделением
NO
и константой
скорости k1
(необратимая
реакция
первого
порядка), вторая
реакция –
образование HbNO с
эффективной
константой
скорости
реакции
псевдопервого
порядка k2.
Для
используемых
концентраций
гемоглобина
((6-7.5)·10-
![]() (6)
(6)
Для k2,
значительно
превышающего
k1 (как в
нашем
случае),
второй
частью
уравнения (6)
можно
пренебречь
из-за малого
значения. Т.о.,
накопление
конечного
продукта
происходит с
константой
скорости
первого
процесса, k1,
согласно
уравнению:
![]() (7)
(7)
Таким
образом, HbNO
образуется
со скоростью,
равной
скорости генерации
NO в растворе.
Конечная
концентрация
HbNO в
экспериментах
определялась
начальной
концентрацией
гемоглобина,
потому что
константа
связывания
гемоглобина
с NO 3·1010 М-1 [11].
Ошибка
измерения
констант
составляет 10 %.
Для
“красной
соли Русина”
(V)
изменение
спектров
поглощения
гемоглобина,
указывающие
на
образование HbNO,
происходило
медленнее.
Эффективная
константа
скорости
первого
порядка для
реакции
взаимодействия
ее с
гемоглобином
6.1·10-5± 6·10-6 с-1.
Для
нитропруссида
натрия (VI)
спектр
поглощения
гемоглобина
начал изменяться
только через
50 минут,
реакция шла очень
медленно в
течение
следующих 4.5
часов, и
концентрация
HbNO лишь
незначительно
увеличивалась.
Изменение
спектра
поглощения
при реакции
гемоглобина
с
диэтилентриамин-NO-атом
(VII)
начиналось
спустя 1,5 часа;
реакция шла
более 10 часов.
Эффективная
константа
скорости
первого
порядка
составляла
8·10-5 с-1.
 Согласно
расчетам [7],
электронную
конфигурацию
железо-нитрозильного
фрагмента в
комплексах, I-IV можно
представить
как {Fe(NO)2}7+2.
Степень
окисления
железа 1+ (d7-конфигурация), поэтому
нельзя
ожидать, что
дезоксигемоглобин
будет
действовать
как
восстановитель
в
исследуемых
реакциях
(известно,
что дезоксигемоглобин
ответственен
за одноэлектронное
восстановление
иона нитрита,
которое
приводит к
образованию Hb-NO). К
тому же, как
показали
эксперименты,
образования
метмиоглобина
– продукта
восстановления
дезоксигемоглобина
– в
исследуемых
системах не
наблюдалось.
Поскольку
скорость
взаимодействия
гемоглобина
с NO
близка
к
диффузионной
(1.02·108 М-1·s-1),
полученные
экспериментальные
значения константы
скорости k
(таблица 4)
свидетельствуют
о том, что
скорость
взаимодействия
комплексов
железа I-IV с
гемоглобином
ограничена
скоростью
разложения
комплексов:
это может
быть обусловлено
как природой
лигандов, так
и типом структуры
(μ2-S или μ-N-C-S)
используемого
донора.
Согласно
расчетам [7],
электронную
конфигурацию
железо-нитрозильного
фрагмента в
комплексах, I-IV можно
представить
как {Fe(NO)2}7+2.
Степень
окисления
железа 1+ (d7-конфигурация), поэтому
нельзя
ожидать, что
дезоксигемоглобин
будет
действовать
как
восстановитель
в
исследуемых
реакциях
(известно,
что дезоксигемоглобин
ответственен
за одноэлектронное
восстановление
иона нитрита,
которое
приводит к
образованию Hb-NO). К
тому же, как
показали
эксперименты,
образования
метмиоглобина
– продукта
восстановления
дезоксигемоглобина
– в
исследуемых
системах не
наблюдалось.
Поскольку
скорость
взаимодействия
гемоглобина
с NO
близка
к
диффузионной
(1.02·108 М-1·s-1),
полученные
экспериментальные
значения константы
скорости k
(таблица 4)
свидетельствуют
о том, что
скорость
взаимодействия
комплексов
железа I-IV с
гемоглобином
ограничена
скоростью
разложения
комплексов:
это может
быть обусловлено
как природой
лигандов, так
и типом структуры
(μ2-S или μ-N-C-S)
используемого
донора.
3. NO-донирование
нитрозильных
комплексов
железа с
2-меркаптоимидазолами
в растворах ДМСО
/ вода
На
рисунках 9 и 10
приведены
временные
зависимости
концентрации
NO,
генерируемого
исследуемыми
комплексами I-IV и
соединениями
V, VII в
аэробных
(рис. 9) и
анаэробных
(рис. 10) условиях
при 250С в
отсутствии
гемоглобина.
В
экспериментах
не проводилось
какой-либо
активации
комплексов,
поэтому на
рисунках
отсутствует
кривая
зависимости
для
нитропруссида
натрия VII,
который
нуждается в
фотоактивации
для выделения
NO. В отличие
от этого
соединения
все сера-нитрозильные
комплексы
железа
генерируют
оксид азота с
первых
секунд после
растворения
в протонном
растворителе.
При этом все
комплексы по
количеству
выделяемого NO
можно
поставить в
ряд (для
комплекса I
наблюдается
максимальное
значение
генерируемого
NO):
I→ II→
III→ IV→
V→ VII
вне
зависимости
от
содержания
кислорода в
системе
(таблица 5).
Концентрация
NO при
регистрации
электродами amiNO
определяется
разностью
скорости
образования
и скорости
деградации NO
в растворе.
Согласно
полученным
данным в анаэробных
условиях в
течение
первых 200
секунд от начала
реакции из 1
моль
комплекса
выделяется в
0,2-1,6 моль NO (для
соединения VII это
значение
составляет 0,07
моль) вместо
ожидаемых 4 и 2
моль,
соответственно.
Можно предположить,
что при
разложении
исследуемых
комплексов в
растворах
образуются
относительно
долгоживущие
нитрозильные
интермедиаты,
как,
например,
наблюдалось
для
комплекса I (см.
Главу 3).
Строение и
времена
жизни таких интермедиатов
планируется
исследовать
в дальнейшем.
Соединение VII, как
и все
диазениумдиолаты
является
донором NO пролонгированного
действия и
способен генерировать
оксид азота в
течение 20 и
более часов в
зависимости
от рН среды.
В
присутствии
кислорода
количество
выделяемого NO
из 1 моль
комплекса
увеличивается
почти вдвое
(таблица 5). При
этом на
кривых
зависимости
СNO от
времени
комплексов I-IV (рис. 9)
в аэробных
условиях
заметны
максимумы,
что говорит о
сложной
кинетике
протекающих
процессов.
Можно
предположить,
что эти
кривые
описывают
изменение
концентрации
продукта,
участвующего
в двух
последовательных
реакциях:
![]() ,
,
где
А – комплекс,
Р – NO,
В – продукты
взаимодействия
оксида азота с
кислородом.
Таблица
5. Количество
NO,
выделяемого
комплексами I-VII в 1% водных
растворах
ДМСО при 250С
и рН=5.5
|
|
Количество
NO, рА(нМ)* |
||||||
|
|
I |
II |
III |
IV |
V |
VI |
VII |
|
Аэробные условия,
|
650000 (719) |
540000 (601) |
450000 (504) |
300000 (343) |
40000 (47) |
- |
150000 (8) |
|
Анаэробные
условия, |
350000 (324) |
300000 (268) |
100000 (147) |
55000 (121) |
150000 (37) |
- |
9000 (13) |
*концентрация комплекса 0,4 · 10-5 моль/л
Как
упоминалось
выше, НОНОаты
считаются на
сегодня
лучшими
соединениями
из всех классов,
существующих
экзогенных
доноров NO,
поскольку
они безактивационно
генерируют NO
при
гидролизе.
Исследуемые
в настоящей
работе
нитрозильные
комплексы
железа I-IV, также
выделяют
оксид азота
при
растворении
в протонных
растворителях
без дополнительной
фото-, термо-
или
ферментативной
активации.
Если
сравнить времена
взаимодействия
гемоглобина
с соединением
VII и,
например,
комплексом IV, то
можно
увидеть, что
комплекс IV начинает
генерировать
NO с первых
минут с
момента
растворения
и продолжает
в течение
полутора
часов, в то
время как
соединение VII через
полтора часа
только
активизируется.
Комплексы I-III
взаимодействуют
с
гемоглобином
ещё быстрее.
ВЫВОДЫ
1. Синтезированы
монокристаллы
и исследовано
строение
методами РСА,
ИК- и
мессбауэровской
спектроскопии
тетранитрозильного
биядерного
комплекса
железа с
тиосульфатным
лигандом –
исходного
соединения для
получения
комплексов
железа с
2-меркаптоимидазолами.
Методами
масс-спектрального
анализа и
спектрами
поглощения в
видимой
области
доказано
существование
моноядерного
динитрозильного
комплекса
железа (ДНКЖтио)
в водных
растворах.
2. Реакциями
обмена
тиосульфатных
лигандов в
ДНКЖтио на
азагетероциклические
тиолилы ряда
2-меркаптоимидазола
получены и
выделены в кристаллическом
состоянии 3
новых
комплекса
состава [Fe2(SR)2(NO)4] c R –
аналогами
природных
меркаптогистидинов.
3. Методами
РСА, ИК- и
Мессбауэровской
спектроскопии
изучено их
строение и
физико-химические
свойства.
Атомы железа
находятся в тетраэдрической
координации
и связаны друг
с другом
посредством
мостика
гетероциклического
лиганда N-C-S. Лиганды
в
исследованных
комплексах
координируют
атом металла в
форме тиола.
4. Исследование
магнитных
свойств
синтезированных
комплексов с
2-меркаптоимидазолами
показало, что
соединения
парамагнитны.
Железо
находится в
высокоспиновой
d7-конфигурации:
два из трех
неспаренных
электронов
иона металла
полностью
спарены с неспаренными
электронами
двух
координированных
групп NO,
а оставшийся
неспаренный
электрон в
каждом из
фрагментов {Fe(NO)2}
связан
антиферромагнитным
взаимодействием
с
неспаренным
электроном
аналогичного
фрагмента
димерной
молекулы.
5. Анализ
масс-спектров
газовой фазы
синтезированных
комплексов
железа
показал, что соединения
устойчивы
при
вакуумировании
(Т = 20оС). При
температурах
выше 20оС они
разлагаются
с
образованием
NO, а также H2O и
молекулярных
ионов,
отвечающих
фрагментам
их тиольных
лигандов.
6. Исследованы
бимолекулярные
реакции гемоглобина
с
синтезированными
комплексами
железа в
водных
растворах и
рассчитаны константы
скорости
этих реакций
в сравнении с
известными
экзогенными
донорами NO:
нитропруссидом
натрия, «красной
солью»
Руссена и
органическим
НОНОатом.
Установлено,
что
эффективные
константы
скорости
реакций
первого
порядка составляют
(4,5-57)·103 с-1, что
на два
порядка выше
(а в случае
НОНОата – на
три), чем у NO-доноров
сравнения.
7. Методом
электрохимического
анализа
водных
растворов
нитрозильных
комплексов
установлено,
что
синтезированные
соединения
генерируют NO в
протонных
средах без
дополнительной
активации,
подобно
органическим
НОНОатам. Количество
образовавшегося
NO и
скорость его
генерации
значительно
(на порядок)
превышает
таковые для
диазениумдиолата.
ЦИТИРОВАННАЯ
ЛИТЕРАТУРА:
1. Вайсбергер А., Проскауэр Э., Риддик Дж., Тупс Э., «Органические растворители. Физические свойства и методы очистки», под ред. Я.М. Варшавского, М.: Мир, 1958
2. Карякин Ю.В., Ангелов И.И. Чистые химические вещества, М.: Химия, 1974 с. 23-24
3.
Sheldrick
G. M. SHELX-97, release 97-2. Program for Crystal Structure Refiniment. Univ.
of Gottingen, Germany, 1997
4. North A.C.T., Phillips D.C., Mathews F.S., “A semi-empirical method of absorption correction”, Acta Cryst. A, V.24, 1968, p. 351-359
5.
Алдошин
С.М., Санина Н.А.,
Ракова О.А.,
Шилов Г.В., Куликов
А.В., Шульга Ю.М.,
Ованесян Н.С.,
«Новый класс
нейтральных
парамагнитных
биядерных
нитрозильных
серосодержащих
комплексов
железа», Изв.
АН, Сер. Хим., 2003,
с.1614-1620
6.
Fontecave
M., Pierre J.-L. “The basic chemistry of nitric oxide and its possible
biological reactions”, Bull. Soc. Chem. Fr., V.131, 1994, p.620-631.
7.
Enemark
J.H., Feltham R.D., “Principles
of structure, bonding, and reactivity for metal nitrosyl complexes”,
Coord. Chem. Rev., V.13, 1974, p.339-406
8. Цукерблат Б.С., Белинский М.И., Магнетохимия и радиоспектроскопия обменных кластеров, Кишинев, Изд-во «Штиинца», 1983, с. 29
9.
Bleaney
B., Bowers K.D., “Anomalous
Paramagnetism of Copper Acetate”, Proc. Roy. Soc. Ser. A, V. 214, 1952, p.451-465
10.
Tsai
F.-T., Chiou S.-J., Tsai M.-C., Tsai M.-L., Huang H.-W., Chiang M.-H., Liaw
W.-F., “Dinitrosyl iron complexes (DNICs) [L2Fe(NO)2]-
(L=thiolate): interconversion among {Fe(NO)2}9 DNICs,
{Fe(NO)2}10 DNICs and [2Fe-2S] clusters, and critical
role of the thiolate ligands in regulating NO release of DNICs”, Inorg.
Chem., V.44, 2005, p.5872-5881
11.
McMahon
T.J., Stamler J.S., Concerted nitric oxide/oxygen delivery by hemoglobin, in:
L. Packer (Ed.), Methods In Enzymology, Academic Press, 301 (1999) Part C,
p. 99-114
ПУБЛИКАЦИИ
ПО ТЕМЕ
ДИССЕРТАЦИИ
Статьи:
1. Васильева С.В., Мошковская Е.Ю., Санина Н.А., Руднева Т.Н., Куликов А.В., Алдошин С.М. «Формирование динитрозильного комплекса железа – необходимый этап в реализации генетической активности Na2[Fe2(S2O3)2(NO)4]», ДАН, Т. 402, №5, 2005, с. 705-710;
2. Санина Н.А., Алдошин С.М., Руднева Т.Н., Головина Н.И., Шилов Г.В., Шульга Ю.М., Мартыненко В.М., Ованесян Н.С., «Синтез, структура и твердофазные превращения нитрозильного комплекса железа Na2[Fe2(S2O3)2(NO)4]·4H2O», Коорд. Хим., Т.31, 2005, №5, с.323-328;
3. Sanina N.A., Aldoshin S.M., Roudneva T.N., Golovina N.I., Shilov G.V., Shulga Yu. M., Ovanesyan N.S., Ikorskiy V.N., Ovcharenko V.I. “Bi-nuclear nitrosyl iron complex with 2-mercapto-imidazolyl: synthesis, structure and magnetic properties”, J. Mol. Struct., V.752, 2005, p.110-114;
4. Sanina N.A., Roudneva T.N., Aldoshin S.M., Shilov G.V., Kortchagin D.V., Shulga Yu.M., Martynenko V.M., Ovanesyan N.S. “Influence of CH3 group of μ-N-C-S ligand on the properties of [Fe2(C4H5N2S)2(NO)4] complex”, Inorg. Chim. Acta, V.359, 2006, p.570-576;
5. Sanina N.A., Syrtsova L.A., Shkondina N.I., Roudneva T.N., Malkova E.S., Bazanov T.A., Kotel’nikov A.I., Aldoshin S.M., “Reactions of sulfur-nitrosyl iron complexes of “g=2.03” family with hemoglobin (Hb): kinetics of Hb-NO formation in aqueous solutions”, Nitric Oxide: Biol.&Chem., V. 16, 2007, p. 181-188;
6.
Санина Н.А., Руднева Т.Н., Алдошин С.М., Чехлов А.Н., Моргунов Р.Б., Курганова Е.В., Ованесян Н.С. «Синтез, строение и NO-донорная активность парамагнитного комплекса [Fe2(SC3H5N2)2(NO)4] как модели нитрозильных [2Fe-2S] белков», Изв. АН. Сер. Хим., 2007, №1, с. 28-34.
7. Руднева Т.Н., Санина Н.А., Курганова Е.В., Моргунов Р.Б., Чехлов А.Н., Шилов Г.В., Алдошин С.М. «Нитрозильные комплексы железа с 2-меркаптоимидазолами: исследование строения и свойств новых доноров NO», Ежегодник ИПХФ РАН, 2006, III часть, с. 108-120.
8. Моргунов Р.Б., Курганова Е.В., Руднева Т.Н., Санина Н.А., Алдошин С.М., «Магнитные свойства тетранитрозильного комплекса железа [Fe2(SC3H5N2)2(NO)4]», Физика Твердого Тела, 2007, Т. 49, №9, с. 1644-1650
Тезисы
докладов:
1. Руднева Т.Н., Санина Н.А. «Нитрозильные комплексы железа с 5’-замещенными 2 меркаптоимидазолами: синтез и спектроскопия», тезисы IV Всероссийской конференции молодых ученых «Современные проблемы теоретической и экспериментальной химии», Саратов, 23-25 июня 2003, с. 163;
2. Руднева Т.Н., Санина Н.А., Кондратьева Т.А. «Кинетика разложения Na2[Fe2(S2O3)2(NO)4] в растворах», тезисы XVI симпозиума по химической физике, Туапсе, 20 сентября-1 октября 2004, с. 194;
3. Руднева Т.Н., Санина Н.А., Алдошин С.М. «Особенности синтеза и свойств биядерных нитрозильных комплексов железа с имидазол-2-тиолами - доноров монооксида азота», тезисы XXII Международной Чугаевской конференции по координационной химии, Кишинев (Молдова), 20-24 июня 2005, с. 477;
4. Корчагин Д.В., Руднева Т.Н. «Синтез, строение и свойсва биядерного нитрозильного комплекса железа с 1-метил-2-меркаптоимидазолом», тезисы V Всероссийской конференции молодых ученых «Современные проблемы теоретической и экспериментальной химии», Саратов, 24-26 июня 2005, с. 10;
5. Малкова Е.С., Шкондина Н.И., Сырцова Л.А., Санина Н.А., Руднева Т.Н., Алдошин С.М. «Использование миоглобина и гемоглобина для поиска эффективных лекарственных препаратов», тезисы III Международного конгресса «Биотехнология: состояние и перспективы развития», Москва, 14-18 марта 2005, с. 135;
6. Курганова Е.В., Моргунов Р.Б., Санина Н.А.. Руднева Т.Н. «Спиновая динамика в биядерном комплексе железа», тезисы XXIV Всероссийской школы-симпозиума молодых ученых по химической кинетики, Клязьма, 14-17 марта, 2006, с. 42;
7. Руднева Т.Н., Санина Н.А. «Нитрозильные комплексы железа с 2-меркаптоимидазолами: исследование строения и свойств новых доноров NO», тезисы конференции «Научные школы Черноголовки – молодежи», Черноголовка, 2 июня 2006, с. 46;
8. Курганова Е.В., Моргунов Р.Б., Руднева Т.Н., Санина Н.А. «ЭПР в нитрозильных комплексах железа», тезисы III Международной конференции «Высокоспиновые молекулы и молекулярные магнетики», Иваново (13-16 июня), 2006, с.40;
9. Кирман М.В., Ованесян Н.С., Руднева Т.Н., Санина Н.А., Шилов Г.В. «Мессбауэровские и магнитные исследования биядерных железо-серных нитрозильных комплексов», тезисы X международной конференции «Мессбауэровская спектроскопия и её применение», Ижевск (18-24 июня), 2006, с. 56;
10. Руднева Т.Н., Санина Н.А., Чехлов А.Н., Алдошин С.М. «Синтез, строение и свойства биядерного нитрозильного комплекса железа с имидазолидин-2-тионом», тезисы IV Национальной кристаллохимической конференции, Черноголовка, 26-30 июня 2006, с.303;
11. Roudneva T.N., Sanina N.A., Gritsenko V.V., Aldoshin S.M. “Nitrosyl iron complexes with derivatives of 2-mercaptobenzimidazole: synthesis, structure and spectroscopy”, abstracts of 1st European Chemical Congress, Budapest, Hungary, 27-31 august 2006, p. 370;
12. Борисова Л.М., Кубасова И.Ю., Киселева М.П., Смирнова З.С., Санина Н.А., Алдошин С.М., Руднева Т.Н. «Противоопухолевая активность тетранитрозильного комплекса железа с имидазол-2-илом», тезисы Всероссийской научно-практической конференции «Отечественные противоопухолевые препараты», Москва, 24-26 марта 2007, опубликованные в Российском биотерапевтическом журнале, Т.6, №1, 2007, с. 42.

