ё
На правах рукописи
СОКОЛОВ АНДРЕЙ ВЛАДИМИРОВИЧ
СИНТЕЗ И ГЕТЕРОЦИКЛИЗАЦИЯ
АЗОЛ-1-ИЛКАРБОКСАМИДРАЗОНОВ
02.00.03 –
органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата
химических наук
Самара – 2006
Работа
выполнена в Самарском государственном университете
Научный
руководитель: доктор химических наук, профессор Пурыгин П. П.
Официальные
оппоненты:
доктор
химических наук, профессор Моисеев Игорь Константинович
кандидат
химических наук, доцент Голиков Алексей Геннадьевич
Ведущая
организация: Институт органической химии им. Н.Д. Зелинского РАН (г. Москва)
Защита состоится 2006
г в на заседании диссертационного
совета Д 212.218.04 при Самарском государственном университете по адресу:
443011, г. Самара, ул. Академика Павлова, 1, зал заседаний.
С диссертацией можно ознакомиться в научной
библиотеке Самарского государственного университета
Автореферат разослан
Ученый секретарь
диссертационного
совета Л.М.
Бахметьева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Лидирующее место в органической
химии, как в теоретическом, так и в практическом аспекте, занимают
азотсодержащие гетероциклические соединения благодаря разнообразию химических
свойств, широким синтетическим возможностям, и наличию среди них большого числа
физиологически активных соединений, как природного, так и синтетического характера.
При этом одной из ключевых
проблем конструирования новых и труднодоступных гетероциклических систем
является поиск доступных полифункциональных субстратов, позволяющих вести
целенаправленный синтез разнообразных гетероциклических структур.
В
этом отношении перспективными являются 1-цианоазолы, имеющие реакционноспособную
цианогруппу и легко элиминируемый азольный фрагмент. В последнее время
появилось достаточно много публикаций о применении подобных соединений в
синтезе гетероциклических систем. Однако исследования, посвященные
взаимодействию 1-цианоазолов с производными гидразина и синтезу на их основе
бигетероциклических систем со связью С-N между циклами, на данный момент отсутствуют. В связи с этим
поиск путей синтеза подобных гетероциклических соединений представляет большой
практический интерес.
Цель работы. Изучение взаимодействия 1-цианоазолов с гидразином и
его производными. Разработка методов синтеза неизвестных ранее
азол-1-илкарбоксамидразонов, изучение закономерностей, направления и границ применения
реакций их гетероциклизации под действием различных нуклеофильных и
электрофильных реагентов. Синтез труднодоступных азотсодержащих би- и
полигетероциклических соединений со связью азот-углерод между гетероциклами.
Проведение первичного биотестирования некоторых синтезированных соединений.
На защиту выносятся:
·
синтез азол-1-илкарбоксамидразонов и азотсодержащих
бигетероциклических структур со связью азот-углерод между циклами на их основе.
·
закономерности протекания реакций гетероциклизации N1-замещенных
азол-1-илкарбоксамидразонов в зависимости от природы заместителя и азольного
фрагмента.
·
результаты изучения реакционной способности
азол-1-илкарбоксамидразонов по отношению к 1,2-диэлектрофилам.
Научная новизна.
1.
Изучена реакция нуклеофильного присоединения гидразина
и его замещенных, гидразидов карбоновых кислот, метилкарбазата и тиосемикарбазида
к 1-цианоазолам. Установлено, что основными продуктами реакции являются
производные азол-1-илкарбоксамидразонов.
2.
Показано, что азол-1-илкарбоксамидразоны
конденсируются с ортоэфирами карбоновых кислот с образованием
3-(азол-1-ил)-1,2,4-триазолов. N1-тиокарбамоил-
и N1-метоксикарбонильные
производные образуют 3-(азол-1-ил)-5-амино-1,2,4-триазолы и
5-(азол-1-ил)-1,2,4-триазолоны-5 соответственно.
3.
Установлено, что N1-ацильные производные азол-1-илкарбоксамидразонов не
подвергаются циклизации в 3-(азол-1-ил)-1,2,4-триазолы. На примере N1-бензоильного производного
показано, что в данном случае реализуется иное направление реакции –
элиминирование азольного фрагмента и образование
2-амино-5-фенил-1,3,4-оксадиазола.
4.
Разработаны методики синтеза производных
3-(азол-1-ил)-1,2,4-триазинов, на основе азол-1-илкарбоксамидразонов и
α,β-дикарбонильных соединений, а также этилцианоформиата.
5.
Изучена внутримолекулярная гетероциклизация
галогензамещенных 1-цианоазолов имидазольного ряда с гидразинами, приводящая к
труднодоступным аминопроизводным конденсированных полиазагетероциклов.
Показано, что реакция проходит через образование соответствующих
азол-1-илкарбоксамидразонов.
Практическая значимость. Разработаны препаративные методы
синтеза азол-1-илкарбоксамидразонов и бигетероциклических соединений со связью
С-N между циклами на их основе. Среди
синтезированных соединений обнаружены вещества, обладающие антимикробной,
фунгицидной, а также иммуностимулирующей активностью.
Апробация работы. Основные результаты работы докладывались на IV и V Всероссийских
конференциях молодых ученых «Современные проблемы теоретической и экспериментальной
химии» (г. Саратов, 2003, 2005), X Всероссийской
конференции «Карбонильные соединения в синтезе гетероциклов» (г. Саратов,
2004), XVI Всероссийской молодежной
научной конференции «Проблемы теоретической и экспериментальной химии» (г.
Екатеринбург, 2006), международной конференции «Органическая химия от Бутлерова
и Бейльштейна до современности» (г. С. Петербург, 2006).
Публикации. По теме диссертации опубликовано 13 печатных работ: 5
статей в центральной печати, 1 статья в сборнике научных трудов, 7 тезисов
докладов на конференциях различных уровней.
Структура и объем работы. Диссертационная работа состоит из
введения, трех глав, выводов и списка литературы. Текст диссертации изложен на
158 стр. машинописного текста, содержит 34 таблицы, 4 рисунка, 221 литературную
ссылку на работы отечественных и зарубежных авторов.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Синтез
азол-1-илкарбоксамидразонов и их производных
1.1. Синтез азол-1-илкарбоксамидразонов
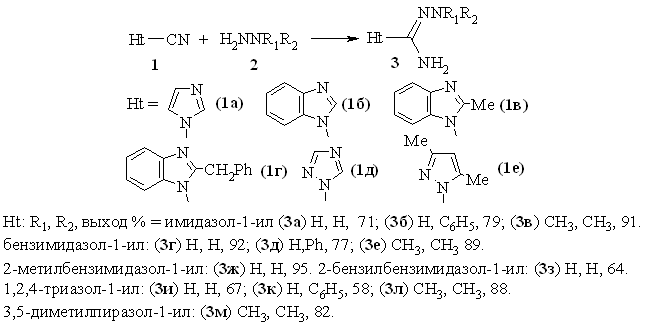
Нами
было изучено взаимодействие 1-цианоазолов 1 с гидразином и его алкил
(арил) замещенными 2. Показано, что в результате образуются продукты
нуклеофильного присоединения - азол-1-илкарбоксамидразоны 3 в соответствии
со схемой:
Реакция
протекает в среде полярного растворителя при пониженных температурах с выходами
56 – 92%. Синтезированные соединения представляют собой бесцветные кристаллические
вещества, стабильные (в отсутствие кислорода воздуха) как в твердом виде, так и
в водных растворах. Исключение составляют незамещенный амидразон
3,5-диметилпиразол-1-илкарбоновой кислоты и его N1-фенильное производное, выделить которые в твердом
виде нам не удалось. В связи с этим указанные соединения использовали в
дальнейших превращениях без выделения из реакционной среды.
Наименьшие
выходы в данной реакции наблюдаются в случае использования
1-циано-1,2,4-триазола. Это объясняется наибольшим электроноакцепторным
характером триазольного ядра и соответственно наибольшей склонностью к
элиминированию гетероцикла.
Строение
азол-1-илкарбоксамидразонов подтверждено данными ИК и ПМР спектроскопии.
Характерной чертой данных соединений является наличие в спектрах ПМР уширенных
сигналов протонов C-NH2 в области
6.12-6.78 м.д., а также сигналов протонов N-NH2 в области
4.74-5.06 м.д. или N-NHPh в области 7.91-8.14 м.д.
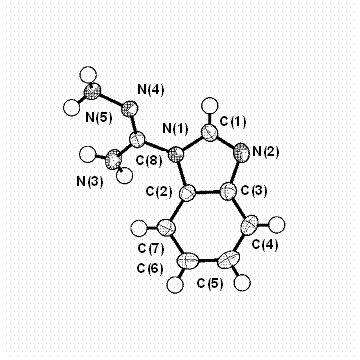 Для
доказательства структуры синтезированных амидразонов, а также определения конформационных
особенностей амидразонов было проведен РСА одного из представителей 3 –
бенз-имидазол-1-илкарбоксамдразона. В кристаллическом состоянии молекула 3г
существует в виде Z-изомера,
относительно С=N связи
амидразонного фрагмента, в амидгидразонной форме. Длина связи С(8)-N(1) составляет 1.417(2) Ǻ, карбоксамидразонная группа образует с плоскостью бензимидазольного
кольца угол в 47.82(6)˚, что может свидетельствовать об отсутствии
π-сопряжения между указанными фрагментами.
Для
доказательства структуры синтезированных амидразонов, а также определения конформационных
особенностей амидразонов было проведен РСА одного из представителей 3 –
бенз-имидазол-1-илкарбоксамдразона. В кристаллическом состоянии молекула 3г
существует в виде Z-изомера,
относительно С=N связи
амидразонного фрагмента, в амидгидразонной форме. Длина связи С(8)-N(1) составляет 1.417(2) Ǻ, карбоксамидразонная группа образует с плоскостью бензимидазольного
кольца угол в 47.82(6)˚, что может свидетельствовать об отсутствии
π-сопряжения между указанными фрагментами.
1.2. Синтез
N1-ацил-(азол-1-ил)-карбоксамидразонов
Кроме гидразинов в реакцию с
1-цианоазолами удается ввести и более слабые нуклеофилы, такие как гидразиды
карбоновых кислот 4:

Реакция
проводится в среде хлористого метилена. Взаимодействие 1-цианоазолов с
гидразидом адамантанкарбоновой кислоты требует кипячения в среде ацетонитрила.
Это может объясняться стерическими затруднениями, которые вызываются
адамантильным остатком. В результате образуются N1-ацил-(азол-1-ил)карбоксамидразоны
с выходами 62-90%, представляющие собой бесцветные кристаллические вещества,
стабильные при хранении. В спектрах ПМР ациламидразонов 5 наблюдаются
сигналы протонов NH2-группы в
области 6.46-7.24 м.д. и сигналы протонов амидного фрагмента NHCO в области 8.60-10.12 м.д.
1.3. Синтез
N1-тиокарбамоил-(азол-1-ил)-карбоксамидразонов
Помимо
гидразидов карбоновых кислот нами был введен в реакцию с 1 тиосемикарбазид.
Реакция проводится при комнатной температуре в среде ДМФА, с образованием N1-тиокарбамоилзамещенных амидразонов
6:
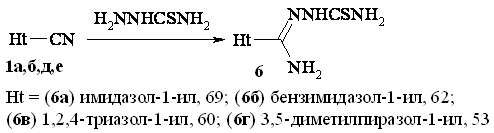
Выходы
в данной реакции составляют 69-84%. В ПМР спектрах 6 имеются сигналы
протонов N3-аминогруппы
в области 6.31-7.31 м.д., а также сигналы протона N1-аминогруппы в области 9.77-12.02 м.д.
2. Синтез
пятичленных гетероциклических систем на основе
азол-1-илкарбоксамидразонов
и их производных
2.1. Синтез
3-(азол-1-ил)-1,2,4-триазолов
Одно
из наиболее характерных свойств амидразонной группы заключается в конденсации с
электрофильными реагентами, приводящей к образованию различных производных
1,2,4-триазола, широко использующихся в качестве средств защиты растений, в
дизайне лекарственных средств, как исходные соединения в синтезе красителей,
высокоэнергетических материалов, а также для нужд комбинаторной химии.
Использование в качестве субстрата азол-1-илкарбоксамидразонов позволяет
синтезировать бигетероциклические структуры со связью азот-углерод между
гетарильными фрагментами, сочетающие в себе несколько фармакофорных групп,
наряду с небольшой молекулярной массой.
2.1.1. Взаимодействие азол-1-илкарбоксамидразонов с
монокарбонильными соединениями
Из
литературы известно, что взаимодействие амидразонов с карбонильными соединениями
может быть использовано в синтезе 1,2,4-триазолов. Нами установлено, что
азол-1-илкарбоксамидразоны конденсируются с карбонильными соединениями, образуя
с высоким выходом алкил(арил)иденовые 7, за исключением формальдегида, в
реакции с которым образуются продукты поликонденсации:
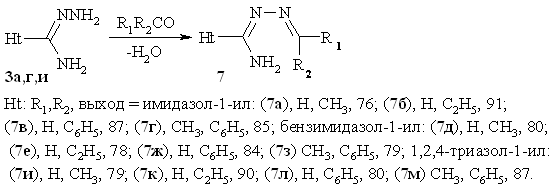
ПМР
спектры 7 характеризуются наличием сигналов протонов NH2 группы в
области 6.97-7.42м.д., а также протона алкил(арил)иденовой группы (если таковой
имеется) в области 7.73-8.51 м.д.
Попытки
окислительной циклизации азометинов в 1,2,4-триазолы не приводят к желаемым
результатам, за исключением окисления бензилиденового производного бензимидазол-1-илкарбоксамидразона
под действием тетраацетата свинца в уксусной кислоте. В результате образуется
3-(бензимидазол-1-ил)-5-фенил-1,2,4-триазол 8 с выходом 78%:
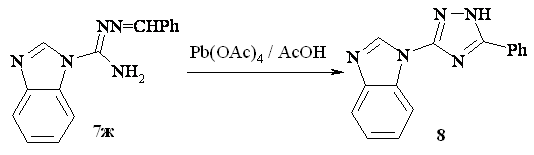
Попытки
окисления имидазольного и триазольного аналогов, равно как замена бензилиденового
остатка этилиденовым, не приводят к успеху.
2.1.2.
Взаимодействие азол-1-илкарбоксамидразонов с ортоэфирами
Удобным
методом синтеза 1,2,4-триазольного цикла является конденсация амидразонов с
ортоэфирами. Нами было установлено, что данный метод применим для получения
3-(азол-1-ил)-1,2,4-триазолов 10. Во взаимодействие вступают как
незамещенные, так и N1-фенилзамещенные
азол-1-илкарбоксамидразоны 3. Реакция проводится при нагревании 3
в избытке ортоэфира. Образование 10 протекает через образование
иминоэфиров 9, которые могут быть выделены в случае незамещенных
азол-1-илкарбоксамидразонов. В качестве ортоэфиров карбоновых кислот были
использованы этилортоформиат и этилортоацетат:

Выходы
в данной реакции составляют 43-91%, причем уменьшение выходов наблюдаются в случае
незамещенных амидразонов, что связано с их меньшей термической стабильностью.
3-(азол-1-ил)-5-R-1,2,4-триазолы
представляют собой бесцветные кристаллические соединения, стабильные в обычных
условиях. ПМР спектры триазолов 10 характеризуются наличием уширенных
сигналов протона NH группы
1,2,4-триазольного ядра (для N-незамещенных
производных) в области 14.6-12.2 м.д. а также сигналов, соответствующих
протонам С-Н группы триазольного ядра (для 5-незамещенных производных).
2.1.3.
Синтез 3-(азол-1-ил)-5-амино-1,2,4-триазолов
Тиокарбамоильные
производные 6 могут служить исходными соединениями в синтезе
3-(азол-1-ил)-5-амино-1,2,4-триазолов 14, которые образуются под
действием десульфирующих средств, таких как оксид ртути (II). Реакция, по-видимому, протекает через образование N1-циано-(азол-1-ил)карбоксамидразонов
12. Аналогичный результат наблюдается при метилировании 7
метилиодидом, последующей нейтрализации и нагреве соответствующих S-метилизотиокарбазидов 11. К
3-(азол-1-ил)-5-амино-1,2.4-триазолам также приводит обработка незамещенных
азол-1-илкарбоксамидразонов бромцианом в присутствии триэтиламина. Наиболее
подходящим растворителем для данных реакций является ДМФА:
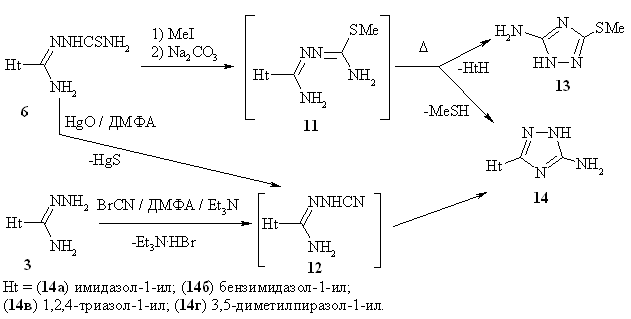
Выходы
аминотриазолов 14 составляют 20-81% в зависимости от используемого метода.
Наименьшие выходы наблюдаются в методе, использующем метилирование с последующей
нейтрализацией и нагревом. Это объясняется конкурирующим процессом нуклеофильного
замещения азольного фрагмента аминогруппой S-метилизотиокарбамоильного фрагмента с образованием
3-метилтио-5-амино-1,2,4-триазола 13. Более высокие выходы (32-58%) наблюдаются
в случае использования оксида ртути (II), однако
выделение конечных соединений затруднено, из-за наличия продуктов окисления
исходных соединений оксидом ртути (II). Наиболее
высокие выходы (53-88%) наблюдаются в методе с применением бромциана.
2.2.
Гетероциклизация N1-ацил-(азол-1-ил)-карбоксамидразонов
Одним
из наиболее распространенных способов синтеза 1,2,4-триазолов является
циклизация N1-ациламидразонов,
протекающая при повышенных температурах либо под действием оснований. Однако N1-ацил-(азол-1-ил)-карбоксамидразоны
5 в данных условиях не циклизуются в соответствующие 1,2,4-триазолы. Под
действием щелочных агентов происходит гидролиз соединений до гетероциклического
основания и карбоновой кислоты.
Нагревание
в присутствии органических оснований, равно как и нагрев выше температуры
плавления приводит к образованию неидентифицируемой смеси продуктов. Исключение
составляют N1-метоксикарбонил-(азол-1-ил)-карбоксамидразоны,
гладко циклизующиеся в 3-(азол-1-ил)-1,2,4-триазолоны-5 15 при кипячении
в ДМФА:
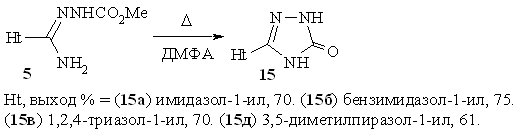
В
случае нагрева в вакууме N1-бензоил(азол-1-ил)карбоксамидразонов
выше температуры плавления нами были выделены соответствующие гетероциклические
основания и 2-амино-5-фенил-1,3,4-оксадиазол 17. Такое течение реакции
можно объяснить термическим разложением N1-бензоил(азол-1-ил)карбоксамидразонов на
гетероциклическое основание и цианогидразид бензойной кислоты 16, циклизующийся
в условиях реакции в 2-амино-5-фенил-1,3,4-оксадиазол:
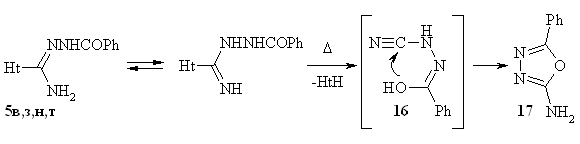
2.3.
Взаимодействие азол-1-илкарбоксамидразонов с β-дикарбонильными соединениями
Нами
показано, что взаимодействие незамещенных амидразонов 3 с ацетилацетоном
или дибензоилметаном приводит к образованию 3,5-диметилпиразола или
3,5-дифенилпиразола 19 и исходного гетероцикла.
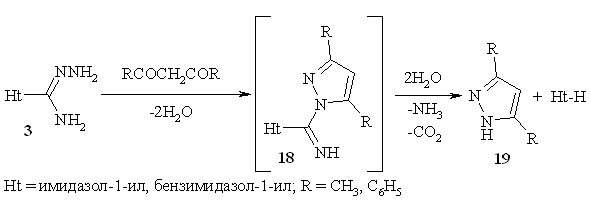
Процесс,
по-видимому, протекает через образование
1-(3,5-диметил(фенил)пиразол-1-ил)-1-(азол-1-ил)карбимина 18, который в
свою очередь гидролизуется водой, выделяемой на первой стадии процесса.
3. Синтез шестичленных гетероциклических структур на основе
азол-1-илкарбоксамидразонов
3.1.
Конденсация азол-1-илкарбоксамидразонов с α-дикарбонильными
соединениями
Азол-1-илкарбоксамидразоны
являются удобными промежуточными соединениями в синтезе производных
1,2,4-триазинов. Нами показано, что взаимодействие азол-1-илкарбоксамидразонов
с α-дикарбонильными соединениями, такими как глиоксаль, диацетил и бензил
приводит к образованию 5,6-дизамещенных-3-(азол-1-ил)-1,2,4-триазинов 31
с выходами 40-94%.

Наименьшие
выходы 1,2,4-триазинов наблюдаются при использовании
3,5-диметилпиразол-1-илкарбоксамидразона ввиду его нестабильности. Реакция
проводится в среде изопропилового спирта. При конденсации с глиоксалем реакцию
проводят при комнатной температуре, с диацетилом при кратковременном нагреве, а
в случае бензила необходимо нагревание в течение 4-10ч. Синтезированные
соединения представляют собой бесцветные или желтоватые кристаллические
соединения. В ПМР спектрах 5,6-незамещенных триазинов имеются сигналы протонов
триазинового кольца в области 7,6-9,55 м.д. Спектры ЯМР 13С
характеризуются наличием сигналов атомов углерода С3 триазинового
фрагмента в области 153-155 м.д., а также сигналов С5 и С6
триазинового кольца в области 149-156 м.д.
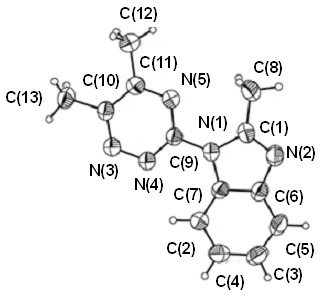 Данные
рентгеноструктурного анализа, полученные для
3-(2-метилбенз-имидазол-1-ил)-5,6-диметил-1,2,4-триазина, показывают, что, в
отличие от бензимидазол-1-илкарбоксамид-разона, вся молекула планарна (угол
между триазиновым и бензимидазольным циклами составляет 1,3˚), однако
длина связи между гетероциклами 1.412(2)
Ǻ остается практически неизменной
Данные
рентгеноструктурного анализа, полученные для
3-(2-метилбенз-имидазол-1-ил)-5,6-диметил-1,2,4-триазина, показывают, что, в
отличие от бензимидазол-1-илкарбоксамид-разона, вся молекула планарна (угол
между триазиновым и бензимидазольным циклами составляет 1,3˚), однако
длина связи между гетероциклами 1.412(2)
Ǻ остается практически неизменной
При
использовании несимметричных α,β-дикарбонильных соединений, таких как
фенилглиоксаль, реакция протекает региоселективно. При взаимодействии
азол-1-илкарбоксамидразонов с фенилглиоксалем образуются исключительно
3-(азол-1-ил)-5-фенил-1,2,4-триазины с выходами 71-88%. Региоселективность объясняется
большей нуклеофильностью N1-атома
амидразонной группы, а также различием реакционной способности карбонильных
групп в фенилглиоксале.
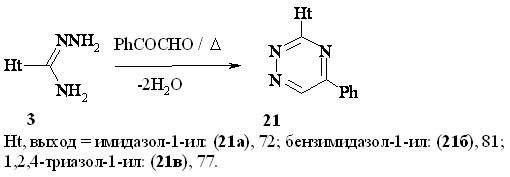
ПМР
спектры 21 характеризуются наличием сигнала протона при 6С атоме
триазинового кольца в области 10.08-11.02 м.д.
3.2.
Взаимодействие азол-1-илкарбоксамидразонов с этилцианоформиатом
Нами показано, что кроме
α,β-дикарбонильных соединений с азол-1-илкарбоксамидразонами
взаимодействует этилцианоформиат, выступая в качестве 1,2-диэлектрофильного
агента. Реакция проводится в спиртовой среде при комнатной температуре и
приводит к образованию 3-(азол-1-ил)-5-амино-1,2,4-триазинонов-5 (22):
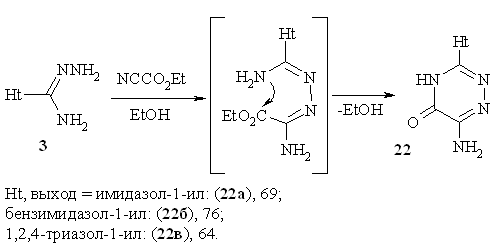
Процесс,
по-видимому, протекает через образование соответствующего аддукта. ПМР спектры
соединений 22 характеризуются наличием сигналов протонов NH2-группы и
лактамной NH-группы
триазинового кольца в области 6.7-7.0 м.д. и 9.1-9.3 м.д. соответственно.
4. Синтез конденсированных систем на основе
азол-1-илкарбоксамидразонов
Наличие
в молекуле исходного 1-цианоазола подвижной группы, способной к нуклеофильному
замещению, позволяет синтезировать конденсированные азотсодержащие системы.
Так, взаимодействие 1-циано-4,5-дихлоримидазола 23 с гидразином приводит
к образованию 3-амино-7-хлоро-1Н-имидазо[5,1-с]-1,2,4-триазола 25.
Реакция протекает через образование
(4,5-дихлоримидазол-1-ил)карбоксамидразона 24, который можно выделить
при проведении реакции при 0-5˚С.

В
ПМР спектре 4,5-дихлоримидазол-1-илкарбоксамидразона имеются два уширенных
синглета при 6.22 м.д. и 5.06 м.д., соответствующие сигналам протонов C-NH2 и N-NH2 групп. При
проведении реакции в кипящем ацетонитриле в присутствии триэтиламина для
связывания выделяющегося HCl образуется
25 с выходом 63%, в ПМР спектре которого имеются уширенные синглеты при
12.56 и 6.47 м.д., соответствующие сигналам протонов эндо- и экзоциклической
аминогрупп триазольного ядра.
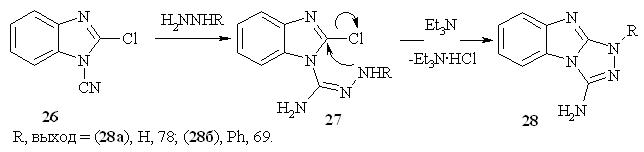
1-Циано-2-хлорбензимидазол
26 в реакции с гидразином, образуя соответствующий амидразон 27,
подвергается аналогичным процессам, приводящим к 3-амино-1Н-1,2,4-триазоло[4,3-а]бензимидазолу
28а. Хотя промежуточные соединения в данном случае выделить не удается,
очевидно, что реакция проходит через образование амидразона, ввиду большей
реакционной способности цианогруппы. Это подтверждается взаимодействием 26
с фенилгидразином, которое приводит к образованию
1-фенил-3-амино-1,2,4-триазоло[4,3-а]бензимидазола 28б, в ПМР спектре
которого имеется уширенный синглет при 6.41 м.д., отвечающий сигналам протонов NH2 группы.
Фенилгидразин
при взаимодействии с 1-циано-2-хлорметилбензимидазолом 29 образует
1-амино-3-фенил-3,4-дигидро-1,2,4-триазино[4,5-а]бензимидазол 31:
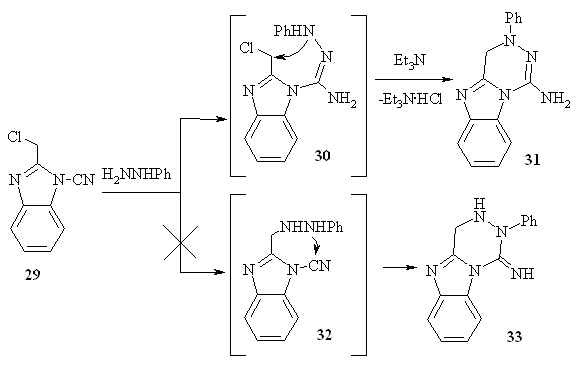
Образование
31 возможно через промежуточное образование амидразона 30, поскольку
только этом случае образуется изомер, в ПМР спектре которого присутствуют
сигналы протонов NH2-группы при
6.18 м.д. в виде уширенного синглета и синглет протонов метиленового звена при
4.78 м.д. в соотношении 1:1.
5.
Результаты биологических испытаний
5.1.
Определение острой токсичности
Совместно
с кафедрой зоологии, генетики и общей экологии СамГУ были проведены
исследования острой токсичности соединений 3а-е, 3и-л, 10в, 20а
на культуре инфузорий Paramecium caudatum.
Показано, что водные растворы азол-1-илкарбоксамидразонов и 1,1-диметиламидразонов азол-1-илкарбоновых
кислот в концентрациях 1мг/мл,
не оказывают острого токсического действия, что свидетельствует о малой
токсичности указанных соединений. Появление
в амидразонном фрагменте фенильного радикала, равно как и замыкание амидразонного
фрагмента в 1,2,4-триазольный или 1,2,4-триазиновый цикл, увеличивают острую
токсичность соединения.
5.2. Определение антимикробных свойств
Совместно с кафедрой общей и
клинической микробиологии, иммунологии и аллергологии СамГМУ нами были изучены
антимикробные свойства соединений 3а-е, 3и-м, 20а,в,г,е,л на
культурах Staphylococcus
aureus, Pseudomonas aeruginosa, Bacillus
cereus, а также Candida albicans.
Установлено, что соединения 3б и 3к обладают бактериостатическим
действием по отношению Staphylococcus aureus в концентрации
10 и 40 мкг/мл соответственно, а также
фунгицидным действием по отношению Candida albicans в
концентрации 80 и 20 мкг/мл соответственно.
5.3. Исследование биологической активности N1-бензоил-(имидазол-1-ил)-карбоксамидразона
по реакциям лейкоцитарной и эритроцитарной систем крови
Совместно
с кафедрой физиологии человека и животных СамГУ нами было проведено
исследование биологической активности N1-бензоил-(имидазол-1-ил)карбоксамидразона
in vivo. В качестве объектов исследования были использованы
крысы. По результатам лейкоцитарных и эритроцитарных реакций крови обнаружено,
что N1-бензоил-(имидазол-1-ил)карбоксамидразон
нетоксичен и оказывает иммуностимулирующее действие, наряду с некоторым
аллергическим влиянием.
Выводы
1.
Разработан метод синтеза различных
азол-1-илкарбоксамидразонов на основе 1-цианоазолов и гидразина и его
производных. Выходы конечных продуктов зависят как от природы 1-цианоазола, так
и от реакционной способности реагента.
2.
Исследована гетероциклизация N1-метоксикарбонил- и N1-тиокарбамоил-(азол-1-ил)карбоксамидразонов,
приводящая к производным 1,2,4-триазолов. Показано, что циклизация N1-ацил-(азол-1-ил)карбоксамидразонов
не приводит к образованию 1,2,4-триазолов. В случае N1-бензоил(азол-1-ил)карбоксамидразонов наблюдается
элиминирование азольного фрагмента и образование
2-амино-5-фенил-1,3,4-оксадиазола.
3.
Показано, что незамещенные и N1-фенилзамещенные азол-1-илкарбоксамидразоны в реакции
с ортоэфирами образуют соответствующие 3-(азол-1-ил)-1,2,4-триазолы.
4.
Установлено, что азол-1-илкарбоксамидразоны
взаимодействуют с монокарбонильными соединениями с образованием
алкил(арил)иденовых производных.
5.
Показано, что α-дикарбонильные соединения, а
также этилцианоформиат реагируют с азол-1-илкарбоксамидразонами с образованием
производных 3-(азол-1-ил)-1,2,4-триазинов, в то время как конденсация с
β-дикарбонильными соединениями приводит к расщеплению амидразонной
структуры и образованию незамещенного азольного и пиразольного фрагментов.
6.
Изучено взаимодействие галогензамещенных 1-цианоазолов
имидазольного ряда с гидразинами. Показано, что реакция приводит к конденсированным
полиазагетероциклам через стадию образования соответствующих амидразонов,
которые в условиях реакции претерпевают внутримолекулярную циклизацию.
7.
Среди синтезированных соединений выявлены вещества,
обладающие антимикробной, фунгицидной, а также иммуностимулирующей активностью.
Основное
содержание диссертации изложено в следующих работах:
1.
Соколов А.В., Комогорцев А.Н., Нечаева О.Н., Пурыгин
П.П. Синтез и гетероциклизация бензимидазол-1-илкарбоксамидразонов // Изв.
ВУЗов. Сер. Химия и хим. технология. – 2005. – Т. 48. – вып. 11. – с. 17-19.
2.
Соколов А.В., Нечаева О.Н., Пурыгин П.П. Реакции
1-цианоазолов с гидразидами карбоновых кислот // Журн. общ. химии. – 2006. –
Т.76. – вып. 1. – с. 41-43.
3.
Соколов А.В., Нечаева О.Н., Пурыгин П.П. Синтез
азол-1-илкарбоксамидразонов и 3-(азол-1-ил)-5,6-ди-R-1,2,4-триазинов // Изв.
ВУЗов. Сер. Химия и хим. технология. – 2006. – Т. 49. – вып. 8. – с.
39-41.
4.
Sokolov
A.V., Vologzhanina
A.V., Purygin
P.P. 1H-Benzimidazole-1-carbohydrazonamide // Acta. Cryst. – 2006. – E62. – o.3209-3210.
5.
Sokolov
A.V., Vologzhanina A.V., Purygin P.P.
1-(5,6-dimethyl-1,2,4-triazin-3-yl)-2-methyl-1H-benzimidazole // Acta. Cryst. –
2006. – E62. – o.3211-3212.
6.
Соколов А.В., Нечаева О.Н., Пурыгин П.П. Синтез
гетероциклических амидинов, амидоксимов и амидразонов на основе N-цианоазолов // Тез. докл. IV Всерос. конф. молодых ученых «Современные проблемы теоретической
и экспериментальной химии», Саратов: Юл. – 2003. – с. 112.
7.
Соколов А.В., Нечаева О.Н., Пурыгин П.П. Синтез и
гетероциклизация азол-1-илкарбокс-(N1-ацил)-амидразонов
// Тез. докл. IV Всерос.
конф. молодых ученых «Современные проблемы теоретической и экспериментальной
химии», Саратов: Юл. – 2003. – с. 42.
8.
Соколов А.В., Нечаева О.Н., Пурыгин П.П. Конденсация
азол-1-илкарбоксамидразонов с α- и β- дикарбонильными соединениями //
«Карбонильные соединения в синтезе гетероциклов»: Сб. науч. тр. Под ред. проф.
Кривенько А.П., Саратов: Научная книга. – 2004. – с. 264-266.
9.
Нечаева О.Н., Соколов А.В., Пурыгин П.П. Конденсация
азол-1-илкарбоксамидразонов с монокарбонильными соединениями // Тез. докл. V Всерос. конф. молодых ученых «Современные проблемы
теоретической и экспериментальной химии», Саратов: Изд-во «Научная книга»,
2005. – с. 33.
10.
Ларкин А.В., Шадричева Н.В., Соколов А.В., Пурыгин
П.П. Синтез и гетероциклизация галогензамещенных N-цианоазолов // Проблемы теоретической и экспериментальной
химии: Тез. докл. XVI Всерос.
науч. конф. Екатеринбург: Изд-во. Урал. ун-та. – 2006. – с. 334-335.
11.
Комогорцев А.Н., Соколов А.В. Взаимодействие
азол-1-илкарбоксамидразонов с 1,2-диэлектрофильными соединениями. // Тез. докл.
международной конф. по орг. химии «Органическая химия от Бутлерова и
Бейльштейна до современности». С. Петербург. – 2006. – с. 282.
12.
Нечаева О.Н., Соколов А.В., Попова О.А., Пурыгин П.П.
Конденсация азол-1-илкарбоксамидразонов с монокарбонильными соединениями. //
Тез. докл. международной конф. по орг. химии «Органическая химия от Бутлерова и
Бейльштейна до современности». С. Петербург. – 2006. – с. 318.
13.
Соколов А.В., Нечаева О.Н., Пурыгин П.П. Синтез
3-(азол-1-ил)-1,2,4-триазолов. // Тез. докл. международной конф. по орг. химии
«Органическая химия от Бутлерова и Бейльштейна до современности». С. Петербург.
– 2006. – с. 347.